
Tot conținutul iLive este revizuit din punct de vedere medical sau verificat pentru a vă asigura cât mai multă precizie de fapt.
Avem linii directoare de aprovizionare stricte și legătura numai cu site-uri cu reputație media, instituții de cercetare academică și, ori de câte ori este posibil, studii medicale revizuite de experți. Rețineți că numerele din paranteze ([1], [2], etc.) sunt link-uri clickabile la aceste studii.
Dacă considerați că oricare dintre conținuturile noastre este inexactă, depășită sau îndoielnică, selectați-o și apăsați pe Ctrl + Enter.
Sistemul de administrare a medicamentelor în buclă închisă ar putea îmbunătăți administrarea chimioterapiei
Ultima examinare: 02.07.2025
 ">
">Când pacienții cu cancer sunt supuși chimioterapiei, dozele majorității medicamentelor sunt calculate pe baza suprafeței corporale a pacientului. Aceasta este estimată folosind o ecuație care ia în considerare înălțimea și greutatea pacientului. Această ecuație a fost formulată în 1916 pe baza datelor de la doar nouă pacienți.
Această abordare simplificată a dozării nu ia în considerare alți factori și poate duce la administrarea unei doze prea mari sau prea mici de medicament către pacient. Drept urmare, unii pacienți pot prezenta toxicitate inutilă sau o eficacitate insuficientă a chimioterapiei pe care o primesc.
Pentru a îmbunătăți precizia dozării chimioterapiei, inginerii de la MIT au dezvoltat o abordare alternativă care permite personalizarea dozei pentru fiecare pacient. Sistemul lor măsoară cantitatea de medicament din corpul pacientului și transmite aceste date către un controler care poate ajusta rata de perfuzie în consecință.
Cercetătorii spun că această abordare ar putea ajuta la compensarea diferențelor de farmacocinetică a medicamentelor cauzate de compoziția corporală, predispoziția genetică, toxicitatea organică indusă de chimioterapie, interacțiunile cu alte medicamente și alimente și variațiile circadiene ale enzimelor responsabile de descompunerea medicamentelor chimioterapice.
„Recunoscând progresele înregistrate în înțelegerea modului în care medicamentele sunt metabolizate și aplicând instrumente inginerești pentru a simplifica dozarea personalizată, credem că putem contribui la transformarea siguranței și eficacității multor medicamente”, a declarat Giovanni Traverso, profesor asociat de inginerie mecanică la MIT, gastroenterolog la Spitalul Brigham and Women's și autor principal al studiului.
Louis DeRidder, student absolvent la MIT, este autorul principal al lucrării publicate în revista Med.
Monitorizare continuă
În acest studiu, cercetătorii s-au concentrat asupra unui medicament numit 5-fluorouracil, care este utilizat pentru tratarea cancerului colorectal și a altor tipuri de cancer. Medicamentul este de obicei administrat pe o perioadă de 46 de ore, iar doza sa este determinată folosind o formulă bazată pe înălțimea și greutatea pacientului, care oferă o estimare a suprafeței corporale.
Totuși, această abordare nu ia în considerare diferențele de compoziție corporală care pot afecta modul în care medicamentul este distribuit în organism sau variațiile genetice care afectează modul în care acesta este metabolizat. Aceste diferențe pot duce la efecte secundare dăunătoare dacă se administrează o cantitate prea mare de medicament. Dacă nu se administrează suficient medicament, este posibil ca acesta să nu distrugă tumora așa cum este așteptat.
„Persoanele cu aceeași suprafață corporală pot avea înălțimi și greutăți foarte diferite, mase musculare diferite sau genetică diferită, dar atâta timp cât înălțimea și greutatea incluse în această ecuație dau aceeași suprafață corporală, doza lor este identică”, spune DeRidder, doctorand în cadrul programului de inginerie medicală și fizică medicală din cadrul Programului Harvard-MIT în Științe ale Sănătății și Tehnologie.
Un alt factor care poate modifica cantitatea de medicament din sânge la un moment dat este variația circadiană a unei enzime numite dihidropirimidin dehidrogenază (DPD), care descompune 5-fluorouracilul. Expresia DPD, la fel ca multe alte enzime din organism, este reglată de un ritm circadian. Astfel, degradarea 5-FU de către DPD nu este constantă, ci variază în funcție de momentul zilei. Aceste ritmuri circadiene pot duce la o variație de zece ori a cantității de 5-FU din sângele unui pacient în timpul unei perfuzii.
„Folosind suprafața corporală pentru a calcula doza de chimioterapie, știm că două persoane pot avea toxicități foarte diferite de la 5-fluorouracil. Un pacient poate avea cicluri de tratament cu toxicitate minimă, iar apoi un ciclu cu toxicitate teribilă. Ceva s-a schimbat în modul în care pacientul a metabolizat chimioterapia de la un ciclu la altul. Metoda noastră de dozare învechită nu surprinde aceste modificări, iar pacienții suferă din cauza lor”, spune Douglas Rubinson, oncolog clinician la Institutul de Cancer Dana-Farber și autor al lucrării.
O modalitate de a încerca să compenseze variabilitatea farmacocineticii chimioterapiei este o strategie numită monitorizare terapeutică a medicamentelor, în care pacientul administrează o probă de sânge la sfârșitul unui ciclu de tratament. După ce această probă este analizată pentru concentrațiile medicamentului, doza poate fi ajustată, dacă este necesar, la începutul următorului ciclu (de obicei, două săptămâni pentru 5-fluorouracil).
S-a demonstrat că această abordare duce la rezultate mai bune pentru pacienți, dar nu a fost utilizată pe scară largă pentru chimioterapii precum 5-fluorouracilul.
Cercetătorii de la MIT au dorit să dezvolte un tip similar de monitorizare, dar într-un mod automatizat, care să permită personalizarea dozării medicamentelor în timp real, ceea ce ar putea duce la rezultate mai bune pentru pacienți.
În sistemul lor cu buclă închisă, concentrațiile de medicament pot fi monitorizate continuu, iar aceste informații sunt utilizate pentru a ajusta automat rata de perfuzie a medicamentului chimioterapeutic pentru a menține doza în intervalul țintă.
Acest sistem în buclă închisă permite personalizarea dozării medicamentelor pentru a ține cont de ritmurile circadiene ale nivelurilor enzimelor care metabolizează medicamentele, precum și de orice modificări ale farmacocineticii pacientului de la ultimul tratament, cum ar fi toxicitatea organică indusă de chimioterapie.
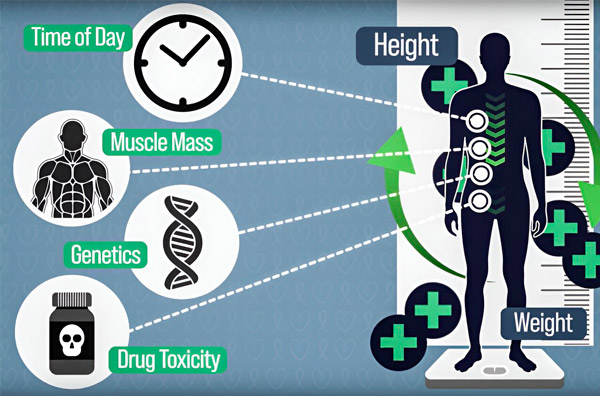
Pentru a face dozarea chimioterapiei mai precisă, inginerii de la MIT au dezvoltat o metodă de măsurare continuă a cantității de medicament din corpul unui pacient în timpul unei perfuzii de mai multe ore. Acest lucru va ajuta la compensarea diferențelor cauzate de compoziția corporală, genetică, toxicitatea medicamentelor și oscilațiile circadiene. Sursa: Prin amabilitatea cercetătorilor.
Noul sistem dezvoltat de cercetători, cunoscut sub numele de CLAUDIA (Closed-Loop AUtomated Drug Infusion regulator), utilizează echipamente disponibile comercial pentru fiecare etapă. Probele de sânge sunt prelevate la fiecare cinci minute și pregătite rapid pentru analiză. Concentrația de 5-fluorouracil din sânge este măsurată și comparată cu intervalul țintă.
Diferența dintre concentrațiile țintă și cele măsurate este introdusă într-un algoritm de control, care apoi ajustează rata de perfuzie după cum este necesar pentru a menține doza în intervalul de concentrații la care medicamentul este eficient și netoxic.
„Am dezvoltat un sistem prin care putem măsura continuu concentrația medicamentului și putem ajusta rata de perfuzie în consecință pentru a menține concentrația medicamentului în fereastra terapeutică”, spune DeRidder.
Reglare rapidă
În testele pe animale, cercetătorii au descoperit că, utilizând CLAUDIA, au putut menține cantitatea de medicament care circulă în organism în intervalul țintă timp de aproximativ 45% din timp.
Nivelurile medicamentului la animalele cărora li s-a administrat chimioterapie fără CLAUDIA s-au menținut în intervalul țintă, în medie, doar în 13% din cazuri. Cercetătorii nu au testat eficacitatea nivelurilor medicamentului în acest studiu, dar se consideră că menținerea concentrațiilor în intervalul țintă are ca rezultat rezultate mai bune și o toxicitate mai mică.
CLAUDIA a reușit, de asemenea, să mențină doza de 5-fluorouracil în intervalul țintă chiar și atunci când s-a administrat un medicament care inhibă enzima DPD. La animalele cărora li s-a administrat acest inhibitor fără monitorizare și ajustare continuă, nivelurile de 5-fluorouracil au crescut de până la opt ori.
Pentru această demonstrație, cercetătorii au efectuat manual fiecare etapă a procesului folosind echipamente standard, dar acum intenționează să automatizeze fiecare etapă, astfel încât monitorizarea și ajustările dozei să se poată face fără intervenție umană.
Pentru a măsura concentrațiile de medicament, cercetătorii au utilizat cromatografie lichidă de înaltă performanță-spectrometrie de masă (HPLC-MS), o tehnică ce poate fi adaptată pentru a detecta aproape orice tip de medicament.
„Vedem un viitor în care putem utiliza CLAUDIA pentru orice medicament care are proprietățile farmacocinetice adecvate și este detectabil prin HPLC-MS, permițând o dozare personalizată pentru multe medicamente diferite”, spune DeRidder.
