
Tot conținutul iLive este revizuit din punct de vedere medical sau verificat pentru a vă asigura cât mai multă precizie de fapt.
Avem linii directoare de aprovizionare stricte și legătura numai cu site-uri cu reputație media, instituții de cercetare academică și, ori de câte ori este posibil, studii medicale revizuite de experți. Rețineți că numerele din paranteze ([1], [2], etc.) sunt link-uri clickabile la aceste studii.
Dacă considerați că oricare dintre conținuturile noastre este inexactă, depășită sau îndoielnică, selectați-o și apăsați pe Ctrl + Enter.
Neuroleptice sau antipsihotice
Expert medical al articolului
Ultima examinare: 04.07.2025
Antipsihoticele (neurolepticele) sunt o clasă de medicamente psihotrope utilizate în principal pentru tratarea schizofreniei. În prezent, este obișnuit să se distingă două grupuri (sau categorii) de medicamente: antipsihotice tipice și atipice. Mai jos sunt informații despre proprietățile farmacologice, indicațiile de utilizare și efectele secundare ale terapiei pentru fiecare dintre aceste grupuri de medicamente.
Indicații pentru utilizarea antipsihoticelor tipice
În prezent, principalele indicații pentru prescrierea neurolepticelor tradiționale, conform recomandărilor furnizate de cercetători autorizați în domeniul psihofarmacoterapiei, includ următoarele.
- Ameliorarea agitației psihomotorii și a tulburărilor comportamentale cauzate de simptome psihotice severe. În aceste cazuri, este indicată utilizarea formelor orale sau parenterale de medicamente cu acțiune antipsihotică, atât globală (clopromazină, levomepromazină, tioproperazină, zuclopentixol), cât și selectivă - sub forma unui efect asupra tulburărilor halucinatorii-paranoide (haloperidol, trifluoperazină).
- Terapie antirecidivă (preventivă). În acest scop, se prescriu medicamente în forme depot, în special la pacienții cu compliance redusă la tratament medicamentos (decanoat de haloperidol, formă prelungită de flupentixol), sau doze mici sau medii de medicamente pentru a obține un efect dezinhibitor (antinegativ), dintre acele medicamente ale căror doze mari sunt utilizate pentru ameliorarea tulburărilor psihotice acute (flupentixol, zuclopentixol). În cadrul acestui tip de terapie, se recomandă și prescrierea așa-numitelor neuroleptice mici (tioridazină, clorprotixen, sulpiridă), a căror activitate psihotropă constă într-un efect asupra manifestărilor polului depresiv și a tulburărilor insomnice.
- Depășirea rezistenței terapeutice la antipsihoticele atipice în tratamentul stărilor psihotice acute. În acest scop, se utilizează de obicei forme parenterale de antipsihotice tradiționale cu acțiune antipsihotică globală (clorpromazină, levomepromazină etc.) și selectivă (haloperidol).
Aceste medicamente provoacă diverse efecte secundare, a căror natură depinde de caracteristicile profilului farmacologic al fiecărui medicament. Antipsihoticele cu un efect colinolitic mai pronunțat provoacă mai des tulburări de acomodare, constipație, uscăciunea gurii și retenție urinară. Efectul sedativ este mai tipic antipsihoticelor cu efect antihistaminic pronunțat, iar hipotensiunea ortostatică este mai tipică medicamentelor care blochează receptorii α1-adrenergici. Blocarea transmiterii colinergice, nordrenergice și dopaminergice de către neurolepticele tipice poate duce la o serie de tulburări în sfera sexuală, cum ar fi amenoreea sau dismenoreea, anorgasmia, galactoreea, umflarea și durerea glandelor mamare și scăderea potenței. Efectele secundare în sfera sexuală sunt asociate în principal cu proprietățile colinolitice și adrenoblocante ale acestor medicamente, precum și cu o creștere a secreției de prolactină din cauza blocării metabolismului dopaminei. Cele mai grave efecte secundare ale neurolepticelor tipice sunt disfuncția motorie. Acestea sunt cel mai frecvent motiv pentru care pacienții întrerup administrarea medicamentelor. Cele trei efecte secundare principale ale terapiei asociate cu influența asupra sferei motorii includ sindroamele extrapiramidale precoce, diskinezia tardivă și NMS.
Se crede că sindroamele extrapiramidale sunt asociate cu blocarea receptorilor D2 din ganglionii bazali. Acestea includ distonia, parkinsonismul neuroleptic și acatizia. Manifestările reacției distonice acute (dischinezie precoce) includ hiperkinezie cu dezvoltare bruscă, crize oculogire, contracții ale mușchilor feței și trunchiului, opistotonus. Aceste tulburări sunt dependente de doză și apar adesea după 2-5 zile de tratament cu neuroleptice foarte puternice, cum ar fi haloperidolul și flufenazina. Pentru ameliorarea diskineziei precoce, doza de neuroleptic este redusă și se prescriu medicamente anticolinergice (biperiden, trihexifenidil). Diskinezia tardivă implică de obicei mușchii gâtului și, spre deosebire de reacția distonică acută, răspunde mai puțin la tratamentul cu anticolinergice. Parkinsonismul neuroleptic este caracterizat prin scăderea abilităților motorii spontane, hipo- și amimie, tremor de repaus și rigiditate. Este important să se distingă aceste simptome de tulburările negative aparent similare din schizofrenie, care sunt reprezentate de alienare emoțională, diminuarea afectivității și anergie. Pentru a corecta aceste efecte secundare, sunt indicate utilizarea anticolinergicelor, reducerea dozei de neuroleptic sau înlocuirea acestuia cu un antipsihotic atipic. Acatizia se manifestă prin anxietate internă, incapacitatea de a rămâne într-un singur loc pentru o perioadă lungă de timp și nevoia de a mișca constant brațele sau picioarele. Pentru a o ameliora, se utilizează anticolinergice și beta-blocante centrale (propranolol).
Diskinezia tardivă se manifestă prin mișcări involuntare ale oricărui grup muscular, cel mai adesea ale mușchilor limbii și gurii. Clinic, se disting o serie de forme ale acesteia: diskinezie a mușchilor obrajilor, limbii, gurii (contracții periodice ale mușchilor masticatori, creând impresia unei persoane care face o grimasă, limba poate ieși involuntar din gura pacientului); distonie tardivă și acatizie tardivă; (pacientul face mișcări coreoatetoide ale capului, trunchiului, membrelor superioare și inferioare). Această formă de tulburare se înregistrează în principal în timpul tratamentului pe termen lung cu neuroleptice tradiționale și este detectată la aproximativ 15-20% dintre pacienții care le iau ca terapie de întreținere. Probabil, la unii pacienți riscul de a dezvolta simptome de diskinezie este crescut, deoarece unele dintre ele au fost observate în clinica schizofreniei chiar înainte de „era neuroleptică”. În plus, diskinezia tardivă a fost descrisă la femei în vârstă și la pacienți cu tulburări afective. Se consideră că diskinezia tardivă este asociată cu o creștere a numărului de receptori de dopamină din striat, deși este probabil ca sistemele GABAergice și alte sisteme neurotransmițătoare să fie, de asemenea, implicate în patogeneza sa. Nu există un tratament universal eficient pentru astfel de efecte secundare. Se sugerează că dozele mici de neuroleptice cu potență mare și acțiune de blocare a dopaminei sau vitamina E pot avea un efect benefic moderat în aceste tulburări. Cea mai eficientă măsură pentru diskinezia tardivă este reducerea dozei unui neuroleptic tipic sau înlocuirea acestuia cu un antipsihotic atipic.
Conform datelor actuale, sindromul neuroleptic malign apare în aproximativ 0,5% din cazurile de psihofarmacoterapie. Probabil, apariția rară a unei astfel de complicații care pune viața în pericol poate fi explicată în prezent prin introducerea pe scară largă în practică a antipsihoticelor atipice, deoarece riscul de a dezvolta SNM în timpul tratamentului cu aceste medicamente este nesemnificativ. Este în general acceptat că principala cauză a dezvoltării SNM este blocarea excesivă a sistemului dopaminergic în timpul terapiei cu neuroleptice, în special după creșterea dozei unui antipsihotic foarte puternic. Principalele simptome ale SNM sunt hipertermia, creșterea tonusului muscular scheletic și a reflexelor tendinoase, afectarea stării de conștiență cu trecerea la comă. Analizele de sânge relevă leucocitoză, creșterea ratei de sedimentare a eritrocitelor, activitatea transaminazelor hepatice; analizele de urină relevă prezența albuminuriei. Tulburările de echilibru hidroelectrolitic apar rapid, ceea ce creează premisele pentru formarea edemului cerebral. SNM este o afecțiune acută care necesită spitalizarea urgentă a pacientului pentru terapie perfuzabilă intensivă. În tratamentul SNM, hidratarea și terapia simptomatică sunt cele mai importante. În această situație, orice neuroleptic prescris necesită întreruperea imediată a tratamentului. În unele cazuri, agoniștii receptorilor dopaminergici (de exemplu, bromocriptina) sau relaxantele musculare au un efect pozitiv, deși eficacitatea lor nu a fost studiată. După eliminarea NMS, administrarea neurolepticului nu trebuie reluată timp de cel puțin două săptămâni. Ulterior, se poate prescrie un antipsihotic cu potență scăzută, de preferință un medicament de nouă generație. Doza medicamentului nou prescris trebuie crescută extrem de atent, monitorizând starea funcțiilor vitale și datele de laborator (analize de sânge și urină).
Neurolepticele tipice rareori provoacă complicații fatale periculoase. Manifestările de supradozaj sunt legate în principal de profilul individual al acțiunii antiadrenergice și anticolinergice a medicamentului. Deoarece aceste medicamente au un efect antiemetic puternic, lavajul gastric este indicat pentru eliminarea lor din organism, mai degrabă decât administrarea de emetice. Hipotensiunea arterială, de regulă, este o consecință a blocării receptorilor adrenergici și trebuie corectată prin administrarea de dopamină și norepinefrină. În caz de aritmie cardiacă, este indicată utilizarea lidocainei.
Mecanismul de acțiune și efectele farmacologice ale antipsihoticelor tipice
Pe măsură ce psihofarmacologia s-a dezvoltat, au fost propuse diverse opțiuni privind efectul antipsihoticelor asupra neuroreceptorilor. Principala ipoteză rămâne că acestea afectează neurostructurile dopaminei (în principal receptorii D2), pe baza datelor privind perturbarea metabolismului normal al dopaminei în structurile cerebrale în psihoze. Receptorii dopaminergici D2 sunt localizați în ganglionii bazali, nucleul accumbens și cortexul frontal; aceștia joacă un rol principal în reglarea fluxului de informații dintre cortexul cerebral și talamus.
Figura demonstrează o înțelegere mai detaliată a perturbărilor transmiterii dopaminei în zonele corticale și subcorticale ale creierului și a rolului acestor perturbări în dezvoltarea simptomelor de schizofrenie (adaptat după monografia lui Jones RB, Buckley PF, 2006).
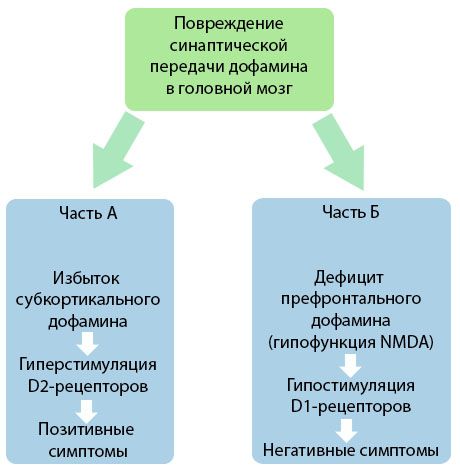
Partea A reflectă teoria clasică, timpurie, a dopaminei, postulând un exces de dopamină în zonele subcorticale și o hiperstimulare a receptorilor D2, ceea ce duce la apariția simptomelor productive. Partea B demonstrează modernizarea ulterioară a teoriei la începutul anilor 1990. Datele obținute până în acest moment au relevat că un deficit de dopamină în receptorii D, împreună cu o stimulare insuficientă a acestor receptori în cortexul prefrontal, duce la apariția simptomelor negative și a deficitelor cognitive. Prin urmare, conform înțelegerii moderne, ambele tipuri de tulburări de transmitere dopaminergică - un exces de dopamină subcorticală și deficitul acesteia în cortexul prefrontal - sunt rezultatul combinat al unei perturbări a transmiterii sinaptice în zona prefrontală și sunt asociate cu hipofuncția N-metil-N-aspartat. Pe lângă dopamina izolată inițial, au fost identificați ulterior și alți neurotransmițători implicați în patogeneza schizofreniei, cum ar fi serotonina, acidul gama-aminobutiric, glutamatul, norepinefrina, acetilcolina și diverse neuropeptide. Deși rolul acestor mediatori nu a fost pe deplin studiat, totuși, pe măsură ce cunoștințele se dezvoltă, devine clară manifestarea a numeroase modificări neurochimice în organism. Prin urmare, efectul clinic al unui medicament antipsihotic este o însumare a efectelor asupra diferitelor formațiuni receptorilor și duce la eliminarea tulburărilor de homeostazie.
În ultimii ani, datorită apariției unor noi metode de cercetare, cum ar fi legarea ligandului radioizotopic și scanarea PET, s-au înregistrat progrese semnificative în elucidarea mecanismului biochimic fin de acțiune al neurolepticelor. În special, a fost determinată puterea comparativă și tropismul medicamentelor de a se lega de neuroreceptori individuali în diverse zone și structuri ale creierului. A fost demonstrată o dependență directă a severității efectului antipsihotic al unui medicament de puterea efectului său de blocare asupra diverșilor receptori dopaminergici. Recent, au fost identificate patru tipuri de astfel de receptori:
- D1 sunt localizați predominant în zona substanței negre și a striatumului (așa-numita regiune nigrostriatală), precum și în regiunea prefrontală;
- D2 - în regiunile nigrostriatale, mezolimbice și în glanda pituitară anterioară (secreție de prolactină);
- D3 (presinaptic) - în diverse structuri cerebrale, controlează activitatea dopaminergică conform legii feedback-ului negativ;
- D4 (presinaptic) - predominant în zonele nigrostriatală și mezolimbică.
În același timp, se poate considera acum dovedit că blocarea receptorilor D2 provoacă dezvoltarea efectelor antipsihotice, sedative secundare, precum și a efectelor secundare extrapiramidale. Alte manifestări clinice ale blocării acestui tip de receptori sunt efectul analgezic și antiemetic al neurolepticelor (reducerea grețurilor și vărsăturilor ca urmare a supresiei centrului vărsăturilor), precum și o scădere a conținutului de hormon de creștere și o creștere a producției de prolactină (efecte secundare neuroendocrine, inclusiv galactoree și nereguli menstruale). Blocarea pe termen lung a receptorilor D2 nigrostriatali duce la apariția hipersensibilității acestora, care este responsabilă de dezvoltarea diskineziilor tardive și a „psihozelor de hipersensibilitate”. Manifestările clinice probabile ale blocării receptorilor presinaptici D3 și D4 sunt asociate în principal cu efectul stimulator al neurolepticelor. Datorită blocării parțiale a acestor receptori în zonele nigrostriatale și mezolimbocorticale, neurolepticele activatoare și incisive (puternice, foarte active) în doze mici pot stimula, iar în doze mari pot suprima transmiterea dopaminergică.
În ultimii ani, interesul pentru funcția sistemelor serotoninergice ale creierului, inclusiv a receptorilor serotoninergici, a crescut brusc. Cert este că, în diferite părți ale creierului, sistemul serotoninergic are un efect modulator asupra structurilor dopaminergice. În special, în regiunea mezocorticală, serotonina inhibă eliberarea de dopamină și, în consecință, blocarea receptorilor postsinaptici 5-HT duce la o creștere a conținutului de dopamină. După cum se știe, dezvoltarea simptomelor negative în schizofrenie este asociată cu hipofuncția neuronilor dopaminergici în structurile prefrontale ale cortexului cerebral. În prezent, sunt cunoscute aproximativ 15 tipuri de receptori centrali 5-HT. S-a descoperit experimental că neurolepticele se leagă în principal de receptorii 5-HT din primele trei tipuri.
Aceste medicamente au un efect predominant stimulator (agonist) asupra receptorilor 5-HT1a. Consecințe clinice probabile: creșterea activității antipsihotice, scăderea severității tulburărilor cognitive, corectarea simptomelor negative, efect antidepresiv și scăderea incidenței efectelor secundare extrapiramidale.
Efectul neurolepticelor asupra receptorilor 5-HT2, în special asupra subtipurilor 5-HT2a, este de o importanță semnificativă. Acestea sunt localizate în principal în cortexul cerebral, iar sensibilitatea lor este crescută la pacienții cu schizofrenie. Capacitatea neurolepticelor de nouă generație de a reduce severitatea simptomelor negative, de a îmbunătăți funcțiile cognitive, de a regla somnul prin creșterea duratei totale a etapelor de somn cu unde lente (unde D), de a reduce agresivitatea și de a ameliora simptomele depresive și durerile de cap asemănătoare migrenei (care apar din cauza tulburărilor cerebrovasculare) este asociată cu blocarea receptorilor 5-HT2a. Pe de altă parte, odată cu blocarea receptorilor 5-HT2a, sunt posibile efecte hipotensive și tulburări de ejaculare la bărbați.
Se crede că efectul neurolepticelor asupra receptorilor 5-HT2c provoacă un efect sedativ (anxiolitic), creșterea poftei de mâncare (însoțită de o creștere a greutății corporale) și o scădere a producției de prolactină.
Receptorii 5-HT3 sunt localizați predominant în regiunea limbică, iar atunci când sunt blocați, efectul antiemetic se dezvoltă mai întâi, iar efectele antipsihotice și anxiolitice sunt, de asemenea, amplificate.
Apariția simptomelor asemănătoare parkinsonismului depinde și de puterea de blocare a medicamentului asupra receptorilor colinergici muscarinici. Efectele colinolitice și de blocare a dopaminei se află într-o oarecare măsură în relații reciproce. Se știe, de exemplu, că în regiunea nigrostriatală receptorii D2 inhibă eliberarea de acetilcolină. Când mai mult de 75% dintre receptorii D2 din regiunea nigrostriatală sunt blocați, echilibrul este perturbat în favoarea sistemului colinergic. Acesta este motivul efectului corectiv al medicamentelor anticolinergice (corectoare) asupra efectelor secundare extrapiramidale neuroleptice. Clorprotixena, clozapina și olanzapina au o afinitate mare pentru receptorii muscarinici și practic nu provoacă efecte secundare extrapiramidale, deoarece blochează simultan receptorii colinergici și dopaminergici. Derivații fenotiazinici ai haloperidolului și piperazinei au un efect pronunțat asupra receptorilor dopaminergici, dar au un efect foarte slab asupra receptorilor colinici. Acest lucru se datorează capacității lor de a provoca efecte secundare extrapiramidale pronunțate, care sunt reduse atunci când se utilizează doze foarte mari, când efectul colinolitic devine sesizabil. Pe lângă reducerea efectului de blocare a dopaminei asupra receptorilor D2 din regiunea nigrostriată și nivelarea efectelor secundare extrapiramidale, un efect colinergic puternic poate provoca deteriorarea funcțiilor cognitive, inclusiv tulburări de memorie, precum și efecte secundare periferice (mucoase uscate, afectarea acomodării vizuale, constipație, retenție urinară, confuzie etc.). Neurolepticele au un efect de blocare destul de puternic asupra receptorilor histaminici de tip I, care este asociat, în primul rând, cu severitatea efectului sedativ, precum și cu o creștere a greutății corporale din cauza creșterii apetitului. Efectele antialergice și antipruriginoase ale neurolepticelor sunt, de asemenea, asociate cu proprietățile lor antihistaminice.
Pe lângă efectele blocante ale dopaminei, antiserotoninergice, colinolitice și antihistaminice, majoritatea neurolepticelor au proprietăți adrenolitice, adică blochează atât receptorii α1 centrali, cât și cei periferici. Adrenoblocantele precum clorpromazina și clorprotixena au un efect sedativ pronunțat. În plus, efectul blocant al acestor medicamente poate provoca reacții adverse neurovegetative (hipotensiune arterială, tahicardie etc.), precum și o creștere a efectului hipotensiv al adrenoblocantelor.
Lucrările unui număr mare de autori oferă date despre puterea de legare (afinitatea) neurolepticelor individuale cu diferite tipuri de neuroreceptori.
Pe baza profilului lor neurochimic de acțiune, antipsihoticele tipice și atipice, printre cele utilizate predominant în practica clinică, pot fi împărțite condiționat în șase grupe.
Primul grup este format din blocante selective ale receptorilor D2 și D4 (sulpiridă, amisudpridă, haloperidol etc.) din grupurile derivaților de benzamidă și butirofenonă. În doze mici, în principal datorită blocării receptorilor presinaptici D4, acestea activează transmiterea dopaminergică a impulsurilor nervoase și au un efect stimulator (dezinhibitor), în doze mari blochează receptorii D2 în toate zonele creierului, ceea ce se manifestă clinic printr-un efect antipsihotic pronunțat, precum și prin efecte secundare extrapiramidale și endocrine (datorită prolactinemiei).
Al doilea grup include blocante ale receptorilor D2 extrem de active, precum și medicamente care blochează slab sau moderat receptorii 5-HT2a și 5-HT1a (flupentixol, flufenazină, zuclopentixol etc.), adică în principal derivați de piperazină ai fenotiazinei sau tioxantene apropiate de acestea ca structură stereochimică. La fel ca medicamentele din primul grup, aceste neuroleptice au, în primul rând, un efect antipsihotic (inciziv) pronunțat și provoacă, de asemenea, efecte psihotice extrapiramidale și prolactinemie. În doze mici, au un efect moderat activator (psihostimulant).
Al treilea grup este format din neuroleptice sedative polivalente care blochează majoritatea neuroreceptorilor într-un mod nediferențiat. Aceste medicamente au un efect de blocare clar pronunțat asupra receptorilor dopaminergici și provoacă, de asemenea, efecte adrenolitice și colinolitice puternice. Aceasta include majoritatea neurolepticelor sedative, în principal derivați alifatici și piperidinici ai fenotiazinei, precum și tioxantenele care sunt apropiate de acestea ca structură stereochimică (clorpromazină, levomepromazină, clorprotixenă etc.). Spectrul activității psihotrope a acestor medicamente este dominat, în primul rând, de un efect sedativ primar pronunțat, care se dezvoltă indiferent de doza utilizată, și de un efect antipsihotic moderat. În plus, datorită efectului lor anticolinergic pronunțat, medicamentele din acest grup provoacă efecte secundare extrapiramidale și neuroendocrine slabe sau moderate, dar duc adesea la dezvoltarea hipotensiunii ortostatice și a altor reacții autonome din cauza blocării pronunțate a receptorilor a1-adrenergici.
Al patrulea grup include neuroleptice care blochează receptorii D2 și 5-HT2a într-un mod echilibrat, adică în aceeași măsură (acesta din urmă într-o măsură puțin mai mare) și receptorii α1-adrenergici într-o măsură moderată. Acest grup include reprezentanți ai noii generații de antipsihotice atipice (risperidonă, ziprasidonă, sertindol), care au structuri chimice diferite. Mecanismul neurochimic de acțiune determină influența lor selectivă în primul rând asupra zonelor mezolimbice și mezocorticale ale creierului. Împreună cu un efect antipsihotic distinct, absența sau exprimarea slabă a efectelor secundare extrapiramidale (la utilizarea dozelor terapeutice), prolactinemia slabă sau moderată și proprietățile adrenolitice moderate (reacții hipotensive), acest grup de neuroleptice este capabil să corecteze simptomele negative prin stimularea indirectă a transmiterii dopaminergice în cortexul cerebral.
Al cincilea grup este format din antipsihotice atipice polivalente cu structură dibenzodiazepinică triciclică sau similară (clozapină, olanzapină și quetiapină). La fel ca medicamentele din al treilea grup, acestea blochează majoritatea neuroreceptorilor într-un mod nediferențiat. Cu toate acestea, receptorii 5-HT2a sunt blocați mai puternic decât receptorii D2 și D4, în special cei localizați în regiunea nigrostriatală. Acest lucru determină absența reală sau un efect extrapiramidal slab și absența efectelor secundare neuroendocrine asociate cu creșterea producției de prolactină, cu un efect antipsihotic distinct și capacitatea de a reduce severitatea simptomelor negative. În plus, toate medicamentele din acest grup au proprietăți adrenolitice și antihistaminice pronunțate, ceea ce determină efectele sedative și hipotensive. Clozapina și olanzapina au, de asemenea, un efect blocant destul de pronunțat asupra receptorilor muscarinici și duc la dezvoltarea efectelor secundare colinolitice.
Astfel, capacitatea de a bloca receptorii dopaminergici postsinaptici cu o creștere compensatorie a sintezei și metabolismului dopaminei este singura proprietate biochimică comună pentru toate neurolepticele luate în considerare în aceste grupuri.
Al șaselea grup include singurul antipsihotic atipic, aripiprazolul, care a apărut relativ recent pe piața psihofarmacologică internă. Acest medicament este un agonist parțial al receptorilor D2-dopaminici și acționează ca antagonist funcțional în stare hiperdopaminergică și ca agonist funcțional în profil hipodopaminergic. Un astfel de profil unic al receptorilor aripiprazolului permite reducerea riscului de tulburări extrapiramidale și hiperprolactinemie în timpul utilizării sale. În plus, aripiprazolul acționează ca agonist parțial al receptorilor 5-HT1a și, în același timp, este un antagonist al receptorilor 5-HT2a. Se presupune că o astfel de interacțiune cu receptorii duce la o funcționare general echilibrată a sistemelor serotonină și dopamină, astfel încât mecanismul de acțiune al aripiprazolului poate fi desemnat ca stabilizarea sistemului dopamină-serotonină.
Astfel, nivelul actual de cunoștințe despre mecanismele neurochimice de acțiune ale neurolepticelor ne permite să propunem o nouă clasificare farmacodinamică, patogenetic mai fundamentată, a acestui grup de medicamente psihotrope. Utilizarea acestei clasificări ne permite să prezicem în mare măsură spectrul activității psihotrope, toleranța și probabilele interacțiuni medicamentoase ale unui anumit medicament. Cu alte cuvinte, caracteristicile activității neurochimice a unui medicament determină în mare măsură caracteristicile activității sale clinice, care ar trebui utilizate la alegerea unui anumit medicament antipsihotic pentru un anumit pacient.
Eficacitatea efectului antipsihotic global al oricărui neuroleptic este estimată folosind așa-numitul echivalent clorpromazinic, care este considerat 1. De exemplu, echivalentul clorpromazinic al haloperidolului = 50. Aceasta înseamnă că eficacitatea antipsihotică a 1 mg de haloperidol este comparabilă cu cea a 50 mg de clorpromazină. Pe baza acestui indicator, a fost elaborată o clasificare care prevede alocarea neurolepticelor cu activitate antipsihotică ridicată (echivalent clorpromazinic > 10,0), medie (echivalent clorpromazinic = 1,0-10,0) și scăzută (echivalent clorpromazinic = 1,0), numită patentitate. Neurolepticele tipice (antipsihotice de primă generație) sunt utilizate pe scară largă în psihofarmacoterapia clinică de aproape o jumătate de secol. Spectrul activității lor terapeutice include:
- acțiune antipsihotică globală sub forma capacității de a reduce uniform și diferențiat diverse manifestări ale psihozei:
- efect sedativ (inhibitor) primar - capacitatea medicamentelor de a ameliora rapid agitația psihomotorie;
- acțiune antipsihotică selectivă, manifestată prin capacitatea de a influența simptomele individuale: delir, halucinații, dezinhibarea pulsiunilor etc.;
- acțiune neurotropă activatoare (dezinhibitoare, dezinhibitoare, antiautistă), manifestată prin dezvoltarea simptomelor extrapiramidale;
- acțiune somatotropă sub forma dezvoltării efectelor secundare neuroendocrine și vegetative;
- efect deprimant, exprimat prin capacitatea unor antipsihotice de a provoca simptome depresive.
Eficacitatea antipsihoticelor de primă generație în tratamentul nu doar al tulburărilor psihotice, ci și al tulburărilor din psihiatria borderline a fost dovedită de nenumărate ori și este incontestabilă. Prin urmare, în ciuda frecvenței ridicate a efectelor secundare ale terapiei atunci când sunt prescrise, acestea continuă să fie utilizate în practica medicală.
Antipsihotice atipice
Ghidurile moderne conțin date despre avantajele utilizării antipsihoticelor de a doua generație în farmacoterapie. Termenul „atipic” (sinonim - antipsihotice de a doua generație) este condiționat și este utilizat în principal pentru comoditatea desemnării noii generații. Comparativ cu neurolepticele tradiționale, medicamentele din acest grup sunt mai eficiente în corectarea tulburărilor negative, afective și cognitive, ceea ce se combină cu o tolerabilitate mai bună și un risc mai mic de simptome extrapiramidale. Diferențele în natura efectului terapeutic al unuia sau altuia dintre medicamentele dintr-o serie de antipsihotice atipice se explică, ca și în grupul neurolepticelor tipice, prin profilul său individual de acțiune farmacologică.
Pentru a clarifica posibilitățile psihofarmacoterapiei cu antipsihotice atipice, este recomandabil să ne concentrăm asupra medicamentelor din acest grup înregistrate în Rusia.
 [ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
[ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
Clozapină (dibenzodiazepină)
Fondatorul grupului de antipsihotice atipice. Mecanismul de acțiune al clozapinei este caracterizat printr-o blocare ușoară a receptorilor D2 cu antagonism simultan ridicat la receptorii 5-HT2a, a1, a2-adrenergici și H1-histaminici. S-a dovedit a fi un antipsihotic eficient în cazurile de rezistență la alte antipsihotice (un medicament din grupul de rezervă) și este indicat și pentru tratamentul maniei cronice, agitației psihotice, agresivității. În practica casnică, clozapina este adesea prescrisă pentru a obține sedare și ca hipnotic la pacienții psihotici. Trebuie recunoscut faptul că o astfel de utilizare a clozapinei nu corespunde profilului său principal de indicații pentru utilizare în terapie. Probabil, atitudinea față de acest antipsihotic ca medicament de importanță secundară ar trebui revizuită, deoarece astăzi este singurul medicament cu eficacitate dovedită la pacienții rezistenți.
Clozapina, spre deosebire de neurolepticele tipice, nu provoacă tulburări extrapiramidale grave datorită afinității scăzute menționate anterior pentru receptorii de O2. De asemenea, s-a constatat că poate fi utilizată pentru tratarea distoniei tardive și a acatiziei severe. Datorită riscului scăzut de a dezvolta SNM, clozapina poate fi considerată un medicament de elecție la pacienții care au suferit anterior de această complicație.
Cu toate acestea, în timpul tratamentului cu clozapină pot apărea o serie de reacții adverse grave. Cea mai periculoasă dintre acestea (chiar și atunci când se prescriu doze mici) este agranulocitoza, care apare la 0,5-1,0% dintre pacienți. Alte reacții adverse importante care pot apărea la utilizarea medicamentului includ somnolență, hipersalivație și creștere în greutate, care este adesea deja crescută în momentul prescrierii clozapinei sub influența terapiei antipsihotice anterioare. De asemenea, trebuie acordată atenție posibilității de a dezvolta tahicardie, hipotensiune arterială și convulsii epileptice în timpul administrării. Probabilitatea apariției convulsiilor depinde de doză. Riscul acestora crește semnificativ dacă doza de clozapină depășește 600 mg/zi. Apariția convulsiilor nu este o contraindicație pentru utilizarea ulterioară a medicamentului, dar necesită înjumătățirea dozei și prescrierea de anticonvulsivante, cum ar fi acidul valproic. Prevenirea reacțiilor adverse ale tratamentului cu clozapină include monitorizarea atentă a numărului de leucocite, precum și a parametrilor ECG și endocrini.
Supradozajul cu clozapină poate provoca depresia stării de conștiență până la dezvoltarea comei, precum și simptome asociate cu efectul colinolitic (tahicardie, delir), convulsii epileptice, depresie respiratorie, sindroame extrapiramidale. Un rezultat fatal poate apărea la administrarea unei doze mai mari de 2500 mg de medicament.
 [ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ], [ 41 ]
[ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ], [ 41 ]
Risperidonă
Un derivat de benzisoxazol cu afinitate ridicată pentru receptorii Dj ai serotoninei și dopaminei, cu efect predominant asupra sistemului serotoninergic. Medicamentul are o gamă largă de indicații de utilizare, inclusiv ameliorarea exacerbărilor, tratamentul anti-recidivă, terapia pentru primul episod psihotic și corectarea simptomelor negative ale schizofreniei. S-a demonstrat că medicamentul îmbunătățește funcția cognitivă la pacienții cu schizofrenie. Au fost obținute date preliminare care arată că risperidona reduce, de asemenea, simptomele afective comorbide la pacienții cu schizofrenie și poate fi un medicament de elecție în tratamentul tulburărilor afective bipolare.
Reacțiile adverse ale tratamentului cu risperidonă, în special tulburările extrapiramidale, sunt dependente de doză și apar mai frecvent la doze care depășesc 6 mg/zi. Alte reacții adverse includ greață, vărsături, anxietate, somnolență și creșterea nivelului seric de prolactină. Utilizarea pe termen lung a risperidonei poate duce la creștere în greutate și la dezvoltarea diabetului zaharat de tip 2, dar cu o probabilitate mai mică în comparație cu clozapina și olanzapina.
Supradozajul poate provoca somnolență, convulsii epileptice, prelungirea intervalului QT și lărgirea complexului QRS și hipotensiune arterială. Au fost descrise cazuri cu deces cauzate de supradozajul cu risperidonă.
Avantajul incontestabil al medicamentului este disponibilitatea formelor lichide și cu dizolvare rapidă (sublinguală), a căror utilizare accelerează pătrunderea medicamentului în organismul pacientului și facilitează controlul asupra aportului acestuia. Există, de asemenea, o formă prelungită a medicamentului - pulbere pentru prepararea unei suspensii pentru administrare intramusculară (consta-risperidonă în microsfere). Este recomandat pentru tratamentul de întreținere al pacienților cu schizofrenie, în special pentru pacienții cu compliance slabă. Este necesar să se țină cont de faptul că medicamentul are nevoie de aproximativ trei săptămâni pentru a intra în fluxul sanguin, prin urmare, la începerea terapiei cu consta-risperidonă, pacientul trebuie să ia suplimentar risperidonă sub formă orală timp de cel puțin 3 săptămâni după prima injecție.
Olanzapină
În ceea ce privește acțiunea farmacologică, este apropiată de clozapină, deoarece are un profil de receptori pleiomorfi cu afinitate semnificativă pentru receptorii serotoninici, muscarinici, a1-adrenergici și histaminici. Activitatea terapeutică a olanzapinei are caracteristici similare cu eficacitatea clozapinei și risperidonei în ceea ce privește impactul asupra simptomelor pozitive, negative și depresive ale schizofreniei. În același timp, au fost obținute date privind eficacitatea mai mare a olanzapinei în comparație cu alte antipsihotice atipice la pacienții cu primul episod psihotic și în corectarea indicatorilor funcției cognitive. Trebuie luat în considerare faptul că la începutul terapiei cu forma de comprimate a medicamentului, poate apărea un efect dezinhibitor rapid cu creșterea agitației psihomotorii și a anxietății. Prin urmare, în tratamentul atacurilor însoțite de agitație psihomotorie severă, este indicată utilizarea formei injectabile a medicamentului.
Olanzapina rareori provoacă tulburări extrapiramidale sau diskinezie tardivă, iar cele mai frecvente efecte secundare asociate utilizării sale sunt tulburările metabolice și creșterea în greutate. S-a stabilit că pacienții care primesc olanzapină prezintă destul de des niveluri crescute de colesterol, lipide plasmatice și o predispoziție la diabet zaharat de tip 2, dar astfel de efecte au fost la fel de frecvente la pacienții care primesc atât olanzapină, cât și clozapină. În același timp, au fost obținute date care arată că creșterea în greutate se corelează cu un răspuns pozitiv la olanzapină (adică servește ca un indicator prognostic important al terapiei) și evoluează spre obezitate doar la 20-30% dintre pacienții care au luat exces de greutate în timpul tratamentului.
Supradozajul poate provoca sedare, efecte anticolinergice toxice, convulsii epileptice și hipotensiune arterială. În prezent, nu există date convingătoare pentru a evalua riscul de deces în caz de supradozaj.
Quetiapină
Este clasificat ca un compus dibenzotiazepinic. Profilul său receptor este în mare măsură similar cu cel al clozapinei. Nivelul de legare al quetiapinei de receptorii D2 este scăzut (mai puțin de 50%) și pe termen scurt, chiar și atunci când se utilizează doze mari. Medicamentul este eficient în tratamentul simptomelor pozitive, negative și generale ale schizofreniei. Există dovezi ale utilizării sale cu succes atât în cazurile de rezistență ridicată la terapie, cât și pentru îmbunătățirea funcției cognitive a pacienților, ceea ce îi dă dreptul să fie recomandat ca antipsihotic de primă linie pentru terapia de întreținere a schizofreniei. În cele din urmă, quetiapina are un efect antidepresiv moderat, activator. Prin urmare, este indicată în tratamentul atacurilor depresive-delirante și al tulburărilor cercului senesto-hipocondriac.
Activitatea timotropă ridicată, demonstrată, a quetiapinei explică faptul că este înregistrată ca mijloc pentru ameliorarea și prevenirea secundară a tulburărilor depresive. Pentru tratamentul episoadelor maniacale în cadrul tulburărilor bipolare de tip I și II, quetiapina este utilizată ca mijloc suplimentar. Absența formelor injectabile limitează oarecum utilizarea sa la pacienții cu agitație și comportament agresiv.
Quetiapina este bine tolerată, practic nu provoacă sindroame extrapiramidale, cu excepția cazurilor în care se utilizează doze maxime. Quetiapina nu provoacă hiperprolactinemie, mai rar decât olanzapina și clozapina, aceasta duce la creștere în greutate și toleranță alterată la glucoză.
Ziprasidonă
Are un profil unic de activitate a receptorilor. Fiind un antagonist puternic al receptorilor 5HT2a și al receptorilor D2, este, de asemenea, un inhibitor activ al recaptării serotoninei și norepinefrinei. Studiile clinice au demonstrat o superioritate semnificativă a ziprasidonei în efectul său asupra simptomelor psihotice și a manifestărilor de agresivitate în comparație cu haloperidolul. Există, de asemenea, date despre efectul pozitiv al ziprasidonei asupra funcțiilor cognitive ale pacienților cu schizofrenie, precum și asupra simptomelor afective comorbide, indicatori ai funcționării sociale. Ziprasidona este de obicei bine tolerată și foarte rar provoacă sindroame extrapiramidale, creștere în greutate și tulburări metabolice. Mai des există o prelungire a intervalului QT peste 460 ms, prin urmare, este recomandabil ca pacienții care primesc acest medicament să fie supuși unui examen ECG atât înainte de prescrierea medicamentului, cât și monitorizării controlului în timpul tratamentului. O atenție deosebită trebuie acordată terapiei concomitente (administrarea de medicamente antiaritmice), care poate agrava prelungirea intervalului QT și poate duce la dezvoltarea aritmiei cardiace, a fibrilației ventriculare.
Sertindol
Aparține derivaților fenilindolului. Are un antagonism funcțional ridicat în raport cu receptorii D2, serotonină (în special receptorii 5-HT2a) și receptorii α1-adrenergici. Conform studiilor electroneurochimice, sertindolul inhibă selectiv receptorii dopaminei în regiunea segmentară ventrală. Această selectivitate, după toate probabilitățile, asigură un risc scăzut de sindroame extrapiramidale și hiperprolactinemie în timpul utilizării medicamentului. Rezultatele studiilor comparative au arătat că sertindolul este comparabil cu haloperidolul în ceea ce privește activitatea antipsihotică. Medicamentul are un efect dezinhibitor pronunțat la pacienții cu simptome negative și depresive, care este superior unui efect similar al rispolept. Există, de asemenea, dovezi care confirmă eficacitatea sertindolului pentru corectarea deficiențelor cognitive la pacienții cu schizofrenie. Sertindolul este în general bine tolerat de pacienți, rareori provoacă sedare și, prin urmare, este recomandat ca medicament de substituție atunci când apar efecte secundare în timpul terapiei cu alte antipsihotice moderne.
Reacțiile adverse grave includ capacitatea medicamentului de a prelungi intervalul QT, ceea ce poate duce la aritmie cardiacă. Analizând studiile post-marketing, a devenit clar că profilul cardiac al sertindolului nu diferă de cel al altor antipsihotice de nouă generație.
Aripiprazol
Are activitate antipsihotică comparabilă cu alte agenți atipici, dar are un efect mai mare asupra parametrilor funcției cognitive a pacienților cu schizofrenie. Acțiunea farmacologică unică menționată mai sus a medicamentului - un agonist parțial al receptorilor D2 - permite reducerea riscului de sindroame extrapiramidale și hiperprolactinemie în timpul utilizării sale.
 [ 42 ], [ 43 ], [ 44 ], [ 45 ], [ 46 ], [ 47 ]
[ 42 ], [ 43 ], [ 44 ], [ 45 ], [ 46 ], [ 47 ]
Amisulpridă
Aparține clasei benzamidelor substituite. Medicamentul se leagă selectiv de subtipurile receptorilor dopaminergici D2 și D3, nu are afinitate pentru subtipurile D1, D4 și D5, precum și pentru receptorii serotoninei, H1-histaminici, a1-adrenergici și colinergici. Utilizat în doze mari, blochează receptorii D2 postsinaptici. În doze mici, efectul său dezinhibitor se manifestă datorită blocării receptorilor presinaptici D2 și D3, datorită căruia utilizarea sa este eficientă și în tratamentul simptomelor negative, deși nu este un antagonist combinat al receptorilor D2 și al receptorilor serotoninei. Rezultatele unui număr de studii indică o activitate antipsihotică pronunțată a medicamentului atunci când este utilizat în doze mari, superioară medicamentelor tradiționale.
 [ 48 ], [ 49 ], [ 50 ], [ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ]
[ 48 ], [ 49 ], [ 50 ], [ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ]
Efectele secundare ale terapiei antipsihotice
Tabelul prezintă principalele efecte secundare ale terapiei antipsihotice atipice.
Pregătire |
|
Tulburări de conducere pe ECG |
Tulburări metabolice (creștere în greutate, niveluri crescute de glucoză, colesterol, trigliceride în sânge) |
||
Clozapină |
. |
++ |
++ |
++- |
|
Risperidonă |
++ |
+/- |
++ |
+/- |
|
Olanzapină |
+ |
+/- |
+++ |
++ |
+++ |
Quetiapină |
+/- |
+ |
+/- |
--- |
|
Ziprasidonă |
+ |
++ |
+/- |
+/- |
+/- |
Sertindol |
++ |
-- |
+/- |
-- |
|
Ariliprazol |
-- |
--- |
+/- |
-- |
-- |
Amisulpridă |
++ |
+/- |
|||
Notă. Severitatea efectelor secundare: „+++” - ridicată; „++” - medie; „+” - scăzută; „+/-” - discutabilă; „-” - absentă.
Sindroame extrapiramidale
Una dintre principalele caracteristici ale antipsihoticelor atipice, spre deosebire de cele tradiționale, este capacitatea lor scăzută de a provoca sindroame extrapiramidale, ceea ce a reprezentat un progres în farmacoterapia de întreținere a schizofreniei. Cu toate acestea, după cum reiese din datele din tabel, atunci când se utilizează medicamente individuale din această serie (risperidonă, amisulpridă), pot apărea astfel de simptome, ceea ce necesită o atenție deosebită la prescrierea lor.
 [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
Anomalii ECG
Posibilitatea dezvoltării efectelor secundare cardiace este o problemă serioasă atunci când se utilizează în terapie unele antipsihotice moderne. În aceste cazuri, vorbim despre prelungirea intervalului QT, ceea ce poate duce la dezvoltarea aritmiei. Tulburările de conducere, în principal prelungirea intervalului QT, sunt cel mai adesea observate în timpul tratamentului cu clozapină, sertindol, ziprasidonă. Patologia concomitentă sub formă de bradicardie, bloc atrioventricular, hipotiroidism poate contribui la apariția acestei complicații în timpul terapiei cu medicamentele menționate mai sus. În prezent, monitorizarea ECG este recomandată aproximativ o dată la 3 luni la pacienții care primesc terapie de întreținere cu antipsihotice atipice.
 [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ]
[ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ]
Tulburări endocrine
În prezent, cea mai mare îngrijorare este cauzată de capacitatea medicamentelor antipsihotice atipice de a provoca creștere în greutate. Creșterea greutății corporale, a nivelului de glucoză și trigliceride din sânge poate duce la tulburări metabolice și la dezvoltarea diabetului de tip 2. În timpul terapiei cu clozapină și olanzapină sunt necesare precauții deosebite și monitorizarea săptămânală a parametrilor biochimici. Conform lui J. Geddes și colab. (2000), PB Jones, PF Buckley (2006), ar trebui recunoscută ca fiind oportună efectuarea unui examen amănunțit al pacienților înainte de a le prescrie un anumit antipsihotic de generație modernă, deoarece se știe că tulburările metabolice apar mai des la pacienții care au avut o predispoziție ereditară, exces de greutate corporală, tulburări ale spectrului lipidic și hiperglicemie înainte de începerea tratamentului. Algoritmul de monitorizare propus de PB Jones, PF Buckley (2006) include mai multe puncte.
- Colectarea istoricului medical și a factorilor familiali privind riscul de tulburări metabolice.
- Înregistrarea indicelui de masă corporală, ECG-ului, tensiunii arteriale și pulsului înainte de începerea tratamentului.
- Colectarea datelor de laborator (glucoză, profil lipidic, colesterol) înainte de începerea terapiei.
- Monitorizarea regulată a indicelui de masă corporală și a semnelor vitale în timpul tratamentului.
- Monitorizarea datelor de laborator în timpul tratamentului.
Apariția hiperprolactinemiei în timpul terapiei antipsihotice se datorează blocării centrale a receptorilor dopaminergici din hipotalamus, ceea ce duce la eliberarea de prolactină din glanda pituitară anterioară. Hiperprolactinemia apare cel mai adesea în cazul tratamentului cu olanzapină, risperidonă și amisulpridă.
 [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ]
[ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ]
Agranulocitoză
O altă complicație gravă a terapiei antipsihotice. Poate fi observată în timpul tratamentului cu clozapină și olanzapină. Conform lui J. Geddes și colab. (2000), a fost diagnosticată în primele 3 luni la 1-2% dintre pacienții care iau aceste medicamente. În acest sens, se recomandă analize de sânge săptămânale pentru pacienții care iau aceste medicamente în primele 18 săptămâni de terapie și monitorizare lunară ulterior. S-a demonstrat că atunci când doza neurolepticelor menționate mai sus este redusă, testul clinic de sânge revine la normal. În același timp, trebuie recunoscut faptul că până în prezent nu există o strategie clară pentru pacienții care prezintă efectele secundare menționate mai sus, asociate cu tulburări metabolice. Cel mai adesea, un antipsihotic atipic este înlocuit cu altul. O altă direcție promițătoare este numirea unei terapii corective speciale, în special utilizarea bromocriptinei pentru corectarea hiperprolactinemiei. Situația ideală este cea în care îngrijirea unui pacient cu astfel de tulburări se realizează cu implicarea periodică a interniștilor, în special a endocrinologilor, cardiologilor și a altor specialiști.
În concluzie, trebuie menționat că, dacă se respectă algoritmii dați pentru prescrierea și monitorizarea nu doar a stării mentale, ci și a celei fizice a pacienților, utilizarea medicamentelor de a doua generație este mai sigură decât neurolepticele tipice.
O serie de alte antipsihotice se află în prezent în stadiul de dezvoltare. Medicamentele de generație următoare vor avea probabil un mecanism de acțiune diferit (de exemplu, un profil GABAergic) și vor putea influența diverse manifestări ale schizofreniei, inclusiv tulburările de deficit propriu-zise.
Atenţie!
Pentru a simplifica percepția informațiilor, această instrucțiune de utilizare a medicamentului "Neuroleptice sau antipsihotice " a fost tradusă și prezentată într-un formular special pe baza instrucțiunilor oficiale de utilizare medicală a medicamentului. Înainte de utilizare citiți adnotarea care a venit direct la medicamente.
Descrierea este furnizată în scopuri informative și nu este un ghid pentru auto-vindecare. Nevoia de acest medicament, scopul regimului de tratament, metodele și doza medicamentului sunt determinate numai de către medicul curant. Auto-medicamentul este periculos pentru sănătatea ta.

