
Tot conținutul iLive este revizuit din punct de vedere medical sau verificat pentru a vă asigura cât mai multă precizie de fapt.
Avem linii directoare de aprovizionare stricte și legătura numai cu site-uri cu reputație media, instituții de cercetare academică și, ori de câte ori este posibil, studii medicale revizuite de experți. Rețineți că numerele din paranteze ([1], [2], etc.) sunt link-uri clickabile la aceste studii.
Dacă considerați că oricare dintre conținuturile noastre este inexactă, depășită sau îndoielnică, selectați-o și apăsați pe Ctrl + Enter.
Medicamente care previn tromboza și îmbunătățesc reologia sângelui
Expert medical al articolului
Ultima examinare: 07.07.2025
În prevenirea formării mai multor microtrombi în timpul șocului și a distrugerii acestora, se pot utiliza diverse abordări farmacologice care utilizează medicamente ce previn formarea trombilor și îmbunătățesc reologia sângelui:
- eliminarea tulburărilor hemodinamice și microcirculatorii sistemice utilizând agenți vasoactivi și inotropi;
- măsuri de îmbunătățire a reologiei sângelui utilizând terapia perfuzabilă rațională și medicamente care restabilesc elasticitatea membranelor eritrocitare (trental sau pentoxifilină);
- prevenirea agregării plachetare și formarea trombilor „albi” inițiali în vasele arteriale mici, cu inițierea ulterioară a cascadei de coagulare;
- inhibarea formării trombilor după activarea cascadei de coagulare sistemică;
- activarea fibrinolizei cu scopul dizolvării cheagurilor de sânge nou formate (fibrinolizină, streptokinază, streptodecază, urokinază etc.) sau, dimpotrivă, inhibarea fibrinolizei atunci când aceasta este generalizată la unii pacienți cu șoc traumatic și sepsis (acid aminocaproic, amben, contrical etc.).
Majoritatea abordărilor enumerate sunt tradiționale, bine dezvoltate în practica tratamentului șocului, au propriile indicații hemoreologice și sunt specificate în capitolele relevante. Prin urmare, în această secțiune este recomandabil să ne oprim asupra analizei abordării generale privind prevenirea formării trombilor în șoc folosind agenți farmacologici care afectează profaza coagulării sângelui. Acest nivel de prevenire a complicațiilor coagulării - apariția, formarea și creșterea „trombilor arteriali albi” - atrage cea mai mare atenție a cercetătorilor.
Diverse și adesea multidirecționale tulburări de coagulare a sângelui cu deteriorarea reologiei acesteia sunt caracteristice diferitelor tipuri de șoc. Cel mai caracteristic tip de șoc septic, endotoxinic, cu arsuri, traumatic și hemoragic este formarea mai multor microtrombi în cele mai mici vase, cauzată de tulburări de hemodinamică sistemică, vasospasm și tulburări de microcirculație, îngroșarea sângelui, nămol, scăderea elasticității membranelor eritrocitare, precum și numeroși factori generali și locali (autocoizi) care inițiază modificări locale în hemostaza coagulării și includerea profazăi coagulării sângelui.
Într-o formă schematică (prescurtată), stadiul inițial al hemocoagulării și mecanismul homeostaziei hemocoagulării locale sunt prezentate după cum urmează.
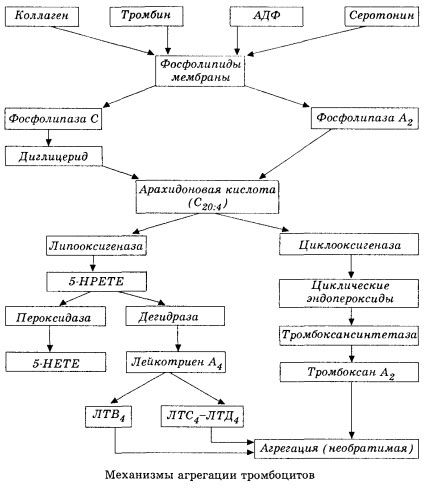
Începe cu activarea fosfolipazei A2 membranare ca urmare a impactului unei combinații de factori nocivi (deteriorarea directă a membranei, hipoxie, peroxidare lipidică, impactul factorilor chimici endogeni etc.). Ca urmare a descompunerii fosfolipidelor membranare, se eliberează acizi grași cu lanț lung neesterificați, dintre care acidul arahidonic este cel mai important ca substrat inițial. Transformarea sa (cascada acidului arahidonic) are loc prin intermediul căilor lipoxigenazei (sinteza leucotrienelor) și ciclooxigenazei (sinteza prostaglandinelor, tromboxanilor, prostaciclinei).
Leucotrienele rezultate (B4, C4, E4, D4 etc.) - substanțe cu activitate biologică extrem de ridicată, printre care se numără și substanța anafilactică cu reacție lentă - au o importanță deosebită în inițierea reacțiilor vasculare, inflamatorii și imune locale, inclusiv a proceselor autoimune. Leucotrienele provoacă tulburări de microcirculație, creșterea coagulării sângelui, eliberarea de enzime lizozomale autolitice și eliberarea în sânge a unui factor care inhibă contractilitatea miocardică și spasmul bronșic.
Datorită capacității lor de a provoca contracția mușchilor netezi, leucotrienele afectează semnificativ hemodinamica sistemică, vasele coronare și miocardul, exercitând un puternic efect constrictor coronarian și inotrop negativ, care este însoțit de o scădere a debitului cardiac și joacă un rol important în dezvoltarea hipotensiunii arteriale.
Debitul cardiac redus și răspunsul hipotensiv la leucotriene sunt asociate cu slăbirea mușchiului cardiac și limitarea întoarcerii venoase către inimă. De o importanță semnificativă în limitarea întoarcerii venoase este capacitatea leucotrienelor de a crește permeabilitatea peretelui vascular și de a provoca extravazarea plasmei. Leucotrienele sunt considerate importante în patogeneza infarctului miocardic.
În șocul anafilactic și septic (endotoxinic), rolul lor crește aparent și mai mult, după cum reiese din capacitatea leucotrienelor de a se acumula în cantități semnificative în plasmă în timpul reacțiilor alergice și de a provoca modificări ale fluxului sanguin sistemic caracteristice șocului anafilactic, precum și din efectele protectoare ale blocantelor receptorilor leucotrienelor și inhibitorilor lipoxigenazei. Dezvoltarea blocantelor selective ale receptorilor leucotrienelor se desfășoară destul de intens și reprezintă o direcție promițătoare a științei. În acest domeniu, s-au obținut deja unele succese, iar eficacitatea acestor blocante în ischemia miocardică, endotoxinică și șocul hemoragic a fost confirmată experimental. Cu toate acestea, probabil că va mai dura câțiva ani până când această direcție va fi implementată clinic.
Dacă în vasele venoase se formează trombi cu participarea egală a trombocitelor și factorilor de coagulare plasmatică, atunci în artere trombocitele sunt principalii inițiatori ai procesului. Acestea conțin ADP, Ca2+, serotonină, fosfolipide, enzime de sinteză a prostaglandinelor și tromboxanului, trombostenină (la fel ca actomiozina musculară, asigură capacitatea contractilă a acestor celule), factor de creștere trombogen al epiteliului și celulelor musculare ale peretelui vascular și o serie de alte substanțe. Reglarea umorală a funcțiilor trombocitelor se realizează prin intermediul receptorilor specializați ai membranelor lor (alfa2- și beta2-adrenergici, receptori pentru histamină și serotonină, acetilcolină, tromboxan, adenozină și o serie de altele). O proprietate specială a trombocitelor este o afinitate ridicată pentru colagen și alte elemente subendoteliale ale peretelui vascular, pentru suprafețele neumidificabile și încărcate negativ. Această proprietate conferă trombocitelor o capacitate excepțională de a adera (lipire) la o secțiune a unui vas cu endoteliu deteriorat, care are ample oportunități de a fi deteriorat în timpul șocului. În acest caz, trombocitele se răspândesc și eliberează pseudopode, care pot adera între ele și la peretele vasului. Permeabilitatea membranei crește, iar ADP, serotonina, tromboxanul și unii factori de coagulare adsorbiți pe suprafața trombocitului sunt eliberați din trombocite. Aceste substanțe interacționează cu receptorii corespunzători de pe membrană și, cu participarea ionilor de calciu, provoacă agregare (inițial reversibilă). Procesul devine auto-susținut, ceea ce este facilitat de factorii de reglare umorali; alți factori, dimpotrivă, îl pot opri și chiar inversa, provocând dezagregarea.
Odată cu predominanța influențelor și condițiilor care formează trombi, fazele de aderență și agregare reversibilă sunt înlocuite de a treia fază - agregarea ireversibilă, care se realizează cu participarea trombosteninei și duce la constricția cheagului; reacția de întărire a agregantului și constricție are loc și cu participarea Ca+, ATP și duce la formarea unui tromb alb.
Calea ciclooxigenazei de conversie a acidului arahidonic în trombocite, celule endoteliale vasculare și alte țesuturi asigură homeostazia coagulării locale (timpul de înjumătățire al metaboliților este foarte scurt), deoarece în timpul acestui metabolism se formează substanțe pro- și antiagregante puternice. Principalul factor care activează agregarea plachetară în lanțul de reacții al ciclooxigenazei este tromboxanul A2, iar antagonistul său nu mai puțin puternic este prostaciclina, produsă de celulele endoteliale și, într-o măsură mai mică, de prostaglandinele din seria E și G. În cele din urmă, agregarea plachetară este puternic influențată de factori umorali locali și sistemici suplimentari.
Activatori și inhibitori ai agregării plachetare
Inițiatori și activatori ai agregării plachetare |
Inhibitori ai agregării plachetare |
Colagen |
- |
ADP |
Adenozina și stabilizatorii săi |
Norepinefrină (prin intermediul receptorilor alfa2) |
Agenți blocanți alfa-adrenergici |
Serotonină |
Agenți antiserotoninici |
Histamină |
Antihistaminice |
Trombină |
Heparină |
Ca2+ |
Antagoniști ai Ca2+ |
CGMP - inductorii săi (acetilcolina?) și stabilizatorii |
CAM - inductorii săi (prin intermediul receptorilor beta-adrenergici) și stabilizatorii (inhibitori ai fosfodiesterazei) |
Acid arahidonic |
Dextrani, albumină |
Tromboxan A2 |
Prostaciclină I2 |
Intervențiile farmacologice în faza inițială a formării trombilor în șoc și în procesele ischemice acute din inimă și creier sugerează următoarea posibilitate:
- inhibarea reacțiilor inițiale (totale și parțiale) ale cascadei acidului arahidonic;
- inhibarea unei anumite reacții de sinteză a tromboxanului;
- blocarea receptorilor pentru leucotriene și tromboxani din trombocite, mușchi netezi și alte celule;
- utilizarea substanțelor care modulează agregarea plachetară, adică slăbesc în alte moduri reacția acestora din urmă la influența factorilor inițiatori (colagen, tromboxan A2, leucotriene etc.).
Implementarea metodelor enumerate de corectare a tulburărilor proprietăților reologice ale sângelui asigură soluționarea principalei sarcini tactice: protejarea receptorilor de agregare și aderență ai trombocitelor de efectul activatorilor sau suprimarea mecanismelor intracelulare de sinteză a acestor receptori. Inhibarea reacțiilor inițiale ale cascadei acidului arahidonic poate fi realizată prin protejarea receptorilor plachetari care reacționează la activatorii polimerici, utilizând dextrani cu greutate moleculară mică, ale căror molecule concurează cu fibrina, colagenul, imunoglobulina agregată (IgE) și componentele sistemului complement.
Prin mascarea receptorilor de pe membrana plachetară și prin concurența cu proteinele dispersate în cantități mari de pe suprafața eritrocitelor, dextranii cu greutate moleculară mică îi deplasează și distrug punțile dintre celule. Acest lucru se datorează faptului că dextranii, care învelesc endoteliul vascular și suprafața elementelor celulare sanguine, le cresc sarcina negativă, sporind astfel proprietățile antiagregante.
Dextrani
Dextranii cu greutate moleculară mică reduc agregarea plachetară indusă de colagen și ADP, precum și efectul activator al trombinei asupra trombocitelor, inhibă creșterea trombului plachetar alb inițial, îmbunătățesc fluxul sanguin, reduc creșterea postoperatorie a conținutului plasmatic de fibrinogen și modifică structura și stabilitatea fibrinei.
Perfuziile intravenoase de dextrani în traumatisme și șoc nu numai că reduc agregarea și aderența plachetară, dar mobilizează și heparina endogenă, promovând astfel formarea unui cheag de sânge lax și greu retractabil, care este ușor lizat de fibrinolitice. Activitatea antitrombinică a dextranilor cu greutate moleculară mică este asociată cu efectul lor specific asupra structurii și funcției factorului VIII de coagulare a sângelui. Factorul VIII (globulina antihemofilă), o moleculă mare cu o structură și o funcție complexe, este implicată în agregarea plachetară și în stabilitatea cheagului rezultat. Dextranii interferează cu acțiunea factorului VIII, încetinind astfel agregarea plachetară și reducând stabilitatea cheagului.
Dextranii cu greutate moleculară mică nu sunt anticoagulante adevărate, iar efectul lor corectiv în afecțiunile hemoreologice este asociat în principal cu hemodiluția, refacerea volumului plasmatic circulant și îmbunătățirea fluxului sanguin în sistemul microcirculator.
Capacitatea dextranilor de a îmbunătăți fluxul sanguin în tulburările hemodinamice (șoc, pierdere de sânge) se datorează unui complex de factori. Apariția unei concentrații tranzitorii ridicate a polimerului în sânge nu numai că duce la „hemodiluție directă”, dar creează și condiții pentru fluxul de fluid în fluxul sanguin din spațiul interstițial și echilibrarea ulterioară a efectului osmotic al dextranului. Ca o consecință a hemodiluției, vâscozitatea sângelui scade, fluxul venos către inimă crește și debitul cardiac crește. Odată cu aceste efecte, dextranii formează complexe cu fibrinogenul și au un efect antilipemic.
Astfel, acțiunea antiagregantă și efectele hemodinamice ale dextranilor cu conținut molecular scăzut ajută la reducerea vâscozității sângelui, ceea ce este deosebit de important la rate de forfecare scăzute. Dezagregarea celulelor sanguine îmbunătățește fluxul sanguin sistemic și microcirculația, în special în partea venoasă, unde gradienții de viteză sunt cei mai mici. Utilizarea soluțiilor de dextran cu conținut molecular scăzut în diferite tipuri de șoc, în timpul tratamentului chirurgical al leziunilor și consecințelor acestora, și apoi în perioada postoperatorie ajută la prevenirea hipercoagulării și la reducerea probabilității proceselor trombotice și a emboliei.
Totuși, trebuie menționat că, în unele cazuri, perfuziile cu soluții de dextran sunt însoțite de reacții anafilactice și alergice (periculoase în prezența sensibilizării și a șocului anafilactic). Acest lucru se datorează faptului că dextranii, care au o greutate moleculară mare și multe lanțuri laterale, pot acționa ca antigen. Prin urmare, pentru a stabili sensibilitatea individuală, se recomandă pre-administrarea intravenoasă a până la 20 ml de soluție de dextran cu greutate moleculară mică sub formă de haptenă (soluție 15%, greutate moleculară 1000) și efectuarea de perfuzii cu un substitut de plasmă înainte de introducerea anesteziei.
 [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
[ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
Inhibitori ai trombinei
Protecția farmacologică a receptorilor plachetari care interacționează cu activatorii plachetari poate fi obținută și folosind agenți care concurează cu activatorii plachetari nepolimerici sau îi inhibă. Printre acești agenți se numără inhibitorii trombinei (heparină și hirudină, o serie de inhibitori sintetici, antagoniști ai adrenalinei), blocanții receptorilor alfa (fentolamină, dihidroergotamină), antagoniștii ADP (dipiridamol, adenozină și analogii săi structurali, fosfocreatina), antagoniștii serotoninei (metisergidă). Doar câțiva dintre agenții enumerați sunt utilizați de fapt pentru prevenirea și terapia șocului de diverse origini.
Protecția mecanismelor intracelulare de sinteză a receptorilor proteici care reacționează cu activatorii agregării și aderenței plachetare și inhibarea proceselor de sinteză a tromboxanului sunt posibile cu medicamente din diferite grupuri:
- inductori și stabilizatori ai cATP, prostaciclinei și prostaglandinei PgE2;
- inhibitori ai fosfolipazei și fosfodiesterazei.
Dezvoltarea intensivă a unor agenți antiplachetari speciali a început relativ recent și nu a dus încă la rezultate fiabile. În prezent, în practica clinică, pe lângă soluțiile de dextran, pentru a preveni formarea trombilor plachetari albi se utilizează pe scară largă agenți antiplachetari precum acidul acetilsalicilic, indometacinul, dipiradamolul, sulfinpirazona (persantin), prostaciclina (eicoprostenona) și heparina.
Medicamente antiinflamatoare nesteroidiene
S-a stabilit că efectele farmacologice ale medicamentelor antiinflamatoare nesteroidiene - acidul acetilsalicilic și indometacina - se datorează efectului lor asupra metabolismului eicosanoidelor (tromboxani și prostaglandine). Aproape toate medicamentele din acest grup inhibă complexul enzimatic cunoscut sub numele de prostaglandin sintetază, exercitând astfel efectele lor specifice și antiagregante.
Acidul acetilsalicilic se absoarbe foarte rapid după administrarea orală. Produsul hidrolizei sale, acidul salicilic, provoacă inhibarea ciclooxigenazei plachetare, ceea ce perturbă conversia acidului arahidonic în prostaglandină O2 și, în final, tromboxan A2. Acidul acetilsalicilic inhibă agregarea indusă de colagen, ADP, adrenalină și serotonină. Deși durata sa de agregare plachetară este de 15 minute, efectul antiagregant durează câteva zile, ceea ce se explică aparent prin inhibarea ireversibilă a reacțiilor de sinteză a prostaglandinelor și suprimarea funcției de agregare plachetară pe întreaga lor viață (6-10 zile). Pe lângă inhibarea ciclooxigenazei plachetare, acidul acetilsalicilic în doze mari inhibă ciclooxigenaza peretelui vascular și, simultan cu suprimarea sintezei tromboxanului A2, inhibă sinteza prostaciclinei în celulele endoteliale. Prin urmare, acidul acetilsalicilic trebuie prescris ca antiagregant în doze mici (3000-5000 mg/zi), care inhibă predominant agregarea plachetară.
Având în vedere că acidul acetilsalicilic blochează ciclooxigenaza plachetară timp de câteva zile, iar ciclooxigenaza endotelială - nu mai mult de o zi, este rațional să se prescrie medicamentul nu zilnic, ci la fiecare 3-4 zile. Selectarea dozei optime de acid acetilsalicilic pentru fiecare pacient trebuie efectuată individual, deoarece există o sensibilitate diferită a pacienților la efectul antiplachetar al medicamentului. La pacienții reactivi, acidul acetilsalicilic într-o doză de 0,5 g inhibă agregarea plachetară cu 40-50%, la pacienții hiperreactivi - complet sau cu 80-90%, iar la pacienții areactivi, absența efectului antiplachetar este caracteristică la administrarea aceleiași doze de medicament.
Inhibitorii selectivi ai tromboxan sintetazei sunt imidazolul și analogii săi, care nu blochează ciclooxigenaza. Dipiridamolul, utilizat în practica clinică în tratamentul cardiopatiei ischemice cronice ca dilatator coronarian, la fel ca imidazolul, inhibă selectiv tromboxan sintetaza, împiedicând sinteza tromboxanului A2. Se crede că medicamentul și analogii săi inhibă, de asemenea, fosfodiesteraza plachetară, crescând astfel concentrația de AMPc în trombocite. Pe lângă aceasta, dipiridamolul inhibă activitatea adenozin deaminazei și absorbția adenozinei de către trombocite, blochează absorbția serotoninei de către trombocite și agregarea acestora indusă de adrenalină și colagen. Există raportări despre o activitate antiplachetară slabă a medicamentului și capacitatea sa în doze mici de a spori agregarea plachetară. Cel mai fiabil efect antiplachetar poate fi obținut cu o combinație de dipiridamol și acid acetilsalicilic.
Heparină
Printre agenții antitrombotici, unul dintre cei mai eficienți regulatori ai stării agregate a sângelui este heparina, în special atunci când este utilizată timpuriu. Heparina are o sarcină negativă ridicată și este capabilă să interacționeze atât cu ioni, cât și cu molecule mari și mici (enzime, hormoni, amine biogene, proteine plasmatice etc.), astfel încât spectrul acțiunii sale biologice este destul de larg. Medicamentul are efecte antitrombinice, antitromboplastinice și antiprotrombinice, previne conversia fibrinogenului în fibrină, suprimă retracția cheagului și crește fibrinoliza.
Mecanismul acțiunii anticoagulante a heparinei este destul de complex. Acum s-a stabilit că efectele anticoagulante ale heparinei sunt asociate cu potențarea acțiunii antitrombinei III și cu creșterea capacității complexului heparină-antitrombină III de a inactiva rapid majoritatea proteazelor serice din sistemul de coagulare a sângelui. În efectul antitrombotic al heparinei, capacitatea sa de a crește și menține un potențial electronegativ ridicat al intimei vasculare, prevenind aderența plachetară și formarea microtrombilor plachetari, este de mare importanță. Heparina suprimă cel mai activ formarea trombilor în vene, prevenind atât formarea trombilor locali, cât și coagularea intravasculară diseminată.
Prostaciclină și analogii săi stabili
Printre agenții antiplachetari, cei mai puternici inhibitori ai agregării sunt prostaciclina și analogii săi stabili. Efectul antiplachetar al prostaciclinei se datorează stimulării adenilat ciclazei și, ca urmare, creșterii concentrației de cAMP în trombocite, scăderii conținutului de tromboxan, scăderii conținutului de tromboxan A2 și blocării receptorilor acestuia. Prostaciclina este instabilă și se hidrolizează rapid în produse inactive, așa că se administrează intravenos prin perfuzie cu o rată de 2 până la 20 ng/kg pe minut, timp de 30-60 de minute, de până la 6 ori pe zi.
Prostaciclina, împreună cu un puternic efect antiagregant, are un efect vasodilatator și bronhodilatator puternic. Medicamentul dilată vasele creierului, inimii, rinichilor, mușchilor scheletici și vaselor mezenterice. Sub influența prostaciclinei, crește fluxul sanguin coronarian, crește aportul de energie al miocardului și scade nevoia acestuia de oxigen. În ciuda instabilității sale în organism, efectele clinic favorabile pot dura câteva săptămâni și chiar luni. Mecanismul unei astfel de acțiuni prelungite nu este încă clar.
Prostaciclina este un medicament cu toxicitate scăzută, dar utilizarea sa poate provoca efecte secundare: înroșirea feței, dureri de cap, scăderea tensiunii arteriale, dureri abdominale, anorexie. Alături de prostaciclină, analogii săi sintetici stabili (iloprost etc.) sunt inhibitori promițători ai agregării plachetare.
Medicamente care îmbunătățesc vâscozitatea sângelui
Tulburările proprietăților reologice ale sângelui în timpul traumatismelor și șocurilor sunt cauzate nu numai de modificările activității funcționale a trombocitelor, ci și de o creștere a vâscozității sângelui. Vâscozitatea structurală a sângelui, ca sistem complex dinamic dispersat, este determinată în mare măsură de vâscozitatea plasmei și de capacitatea eritrocitelor de a se deforma. Vâscozitatea plasmei depinde în principal de concentrația de proteine din sânge. Proteinele cu o greutate moleculară mică, cum ar fi albumina, au un efect redus asupra vâscozității plasmatice, în timp ce proteinele cu o moleculă mare (fibrinogen, alfa- și gama-globuline, alte macromolecule) o cresc semnificativ.
La rate mici de forfecare, adsorbția fibrinogenului și a globulinelor pe suprafața eritrocitelor duce la formarea de punți între celulele adiacente și la formarea de agregate din eritrocite. Rata de formare a agregatelor este un proces biofizic complex și depinde nu numai de magnitudinea forfecării, ci și de proprietățile electrocinetice ale eritrocitelor, de concentrația, masa și capacitatea de sorbție a macromoleculelor-agregatoare, de forma și plasticitatea eritrocitelor.
Menținerea formei și a proprietăților mecanice ale membranei eritrocitare necesită un consum energetic semnificativ. Se crede că energia produsă în eritrocite în timpul glicolizei este cheltuită pentru fosforilarea spectrinei, ceea ce duce la modificări ale structurii secundare a proteinei și la interacțiunea cu componentele vecine ale membranei interne. Interacțiunea dintre proteinele structurale ale membranei, spectrină și actină, joacă un rol important în formarea proprietăților mecanice ale membranei eritrocitare, în menținerea unei suprafețe constante a eritrocitului și a grosimii acestuia sub orice deformare.
În cazul tulburărilor hemodinamice sistemice și ale fluxului sanguin la nivelul organelor, creșterea rigidității membranelor eritrocitare și formarea agregatelor eritrocitare duce la o scădere a ratei de trecere a eritrocitelor prin capilare, perturbând astfel funcția de transport al gazelor în sânge. Prin urmare, corectarea tulburărilor proprietăților reologice ale sângelui în stare de șoc ar trebui să includă, alături de prevenirea agregării eritrocitare, normalizarea vâscozității plasmatice și sanguine, agregarea și deformarea eritrocitelor.
Pe lângă dextranii cu conținut molecular scăzut, soluțiile de albumină reprezintă unul dintre mijloacele eficiente de creștere a stabilității suspensiei sanguine. În perioada târzie de șoc, agregarea generalizată a eritrocitelor are loc pe fondul unei scăderi a concentrației de albumină în plasma sanguină și a unei creșteri a concentrației de fibrinogen și globuline, în special fracția alfa2, lipoproteine și lipide. În aceste condiții, efectele reologice ale albuminei se datorează a doi factori principali: hemodiluția și normalizarea raportului dintre proteinele micro- și macroglobulare din plasmă. În același timp, albumina leagă acizii liberi, a căror labilitare în timpul traumatismelor și șocului stimulează agregarea structurilor celulare ale sângelui și coagularea intravasculară și poate provoca embolie grasă.
Măsurile antișoc care vizează refacerea volumului de sânge circulant, eliminarea hipoxiei tisulare și a acidozei metabolice contribuie la normalizarea elasticității membranelor eritrocitare, deoarece hipoxia și acidoza reduc semnificativ deformabilitatea eritrocitelor. Rigiditatea crescută a membranelor eritrocitare în șoc este probabil asociată cu inhibarea sintezei ATP în eritrocite. La rândul său, o scădere a concentrației de ATP contribuie la o creștere a concentrației de Ca2+ în eritrocite, care, prin legarea de proteinele membranare, crește rigiditatea membranei.
Unul dintre medicamentele farmacologice care crește conținutul de ATP din eritrocite și elasticitatea membranelor eritrocitare este Trental (pentoxifilină), care este utilizat în practica clinică pentru tratarea tulburărilor ischemice.
Pe lângă reducerea rigidității membranelor eritrocitare, Trental provoacă vasodilatație, îmbunătățește oxigenarea țesuturilor, inhibă activitatea fosfodiesterazei în țesuturi, crește concentrația de AMPc și inhibă agregarea plachetară.
Printre alți agenți farmacologici care mențin elasticitatea membranei eritrocitare, merită menționate antagoniștii Ca2+, care limitează fluxul de ioni în eritrocite (flunarizina, nifedipina etc.).
 [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
[ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
Atenţie!
Pentru a simplifica percepția informațiilor, această instrucțiune de utilizare a medicamentului "Medicamente care previn tromboza și îmbunătățesc reologia sângelui" a fost tradusă și prezentată într-un formular special pe baza instrucțiunilor oficiale de utilizare medicală a medicamentului. Înainte de utilizare citiți adnotarea care a venit direct la medicamente.
Descrierea este furnizată în scopuri informative și nu este un ghid pentru auto-vindecare. Nevoia de acest medicament, scopul regimului de tratament, metodele și doza medicamentului sunt determinate numai de către medicul curant. Auto-medicamentul este periculos pentru sănătatea ta.

