
Tot conținutul iLive este revizuit din punct de vedere medical sau verificat pentru a vă asigura cât mai multă precizie de fapt.
Avem linii directoare de aprovizionare stricte și legătura numai cu site-uri cu reputație media, instituții de cercetare academică și, ori de câte ori este posibil, studii medicale revizuite de experți. Rețineți că numerele din paranteze ([1], [2], etc.) sunt link-uri clickabile la aceste studii.
Dacă considerați că oricare dintre conținuturile noastre este inexactă, depășită sau îndoielnică, selectați-o și apăsați pe Ctrl + Enter.
Inteligența artificială detectează cancerul de prostată în stadiu incipient, trecut cu vederea de patologi
Ultima examinare: 23.08.2025
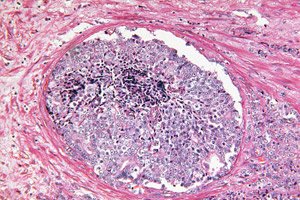 ">
">Scientific Reports demonstrează că inteligența artificială poate recunoaște indicii morfologice ascunse ale tumorii în biopsiile de prostată, care anterior erau considerate benigne de către un patolog. Un model de învățare profundă antrenat folosind abordarea slab supravegheată a prezis care bărbați cu PSA crescut ar dezvolta cancer de prostată semnificativ clinic (ISUP > 1) în următoarele 30 de luni și care ar rămâne fără cancer timp de cel puțin 8 ani. Acest lucru deschide calea către o stratificare timpurie a riscului imediat după o biopsie inițială „curată” și poate ajuta la deciderea cine are nevoie cu adevărat de proceduri invazive repetate și de o supraveghere sporită.
Contextul studiului
Biopsia primară cu ac a prostatei dă adesea rezultate fals negative: o proporție semnificativă de cancere semnificative clinic rămâne „în afara ecranului”, în special în cazul biopsiei transuretrale sistematice tradiționale. Introducerea ghidării RMN a crescut proporția de detectare a cancerului semnificativ clinic și a redus numărul de proceduri repetate inutile, dar chiar și cu strategii moderne, unele tumori agresive rămân nedetectate. Dilema clinică rămâne aceeași: cine ar trebui observat după o biopsie „curată” și cine ar trebui trimis pentru o biopsie repetată precoce, pentru a nu întârzia diagnosticul și a nu supraîncărca pacienții cu intervenții invazive.
Baza biologică pentru rezolvarea acestei probleme este fenomenul TINT (tumor-instructed/indicating normal tissue - țesut normal instruit de tumoră/indicator): o tumoră „reconfigurează” țesuturile aparent normale din jur ale organului, lăsând în ele urme slabe, dar sistematice - de la remodelarea stromală și hipoxie până la schimbări metabolice. Aceste modificări au fost descrise în modele experimentale și la pacienți cu cancer de prostată și se corelează cu agresivitatea tumorii, ceea ce face din țesutul „normal” o sursă potențială de semnale diagnostice, chiar dacă nu există glande canceroase evidente în miezul biopsiei.
Patologia digitală și metodele de învățare profundă au ca scop extragerea unor astfel de caracteristici „subtile” ale câmpului din secțiunile standard de H&E. Spre deosebire de morfologia clasică, care se concentrează pe structurile tumorale evidente, algoritmii pot capta modele distribuite în stromă și epiteliu asociate cu prezența unei tumori într-o altă parte a organului. Acest lucru deschide calea către stratificarea riscului imediat după o biopsie negativă: un „scor” Glass mare sugerează oportunitatea unei biopsii repetate timpurii sau a unei ghidări RMN, în timp ce unul scăzut susține o observare mai blândă.
Aceasta este ideea din spatele unui nou studiu publicat în Scientific Reports: autorii au testat dacă inteligența artificială poate prezice cancerul de prostată semnificativ clinic în următoarele 30 de luni, pe baza indiciilor morfologice obținute prin biopsii TINT. Lucrarea se bazează pe o publicație preprint prezentată anterior și constituie o bază aplicată pentru implementarea biomarkerilor digitali „de teren” în rutarea pacienților după o biopsie inițială „curată”.
Cum a fost realizat: design, date, algoritm
Autorii au colectat retrospectiv o cohortă de 232 de bărbați cu PSA crescut și o concluzie inițială de „benign” la biopsia cu ac (după controlul tehnic, 213 pacienți și 587 de secțiuni au fost incluși în analiza finală; biopsii 1997-2016, Umea, Suedia). Fiecare pacient a fost asociat cu o pereche „oglindă” în funcție de vârstă, anul diagnosticului și nivelul PSA: jumătate au fost diagnosticați cu cancer de prostată mai târziu (≤30 de luni), cealaltă jumătate a rămas fără cancer timp de cel puțin 8 ani. Lamele H&E au fost digitalizate (20×), tăiate în plăci de 256×256 pixeli și introduse în CLAM (Clustering-constrained Attention Multiple-Instance Learning - Învățare Multiplă a Atenției Constrânse prin Clustering) - o schemă modernă slab supravegheată, în care se cunoaște doar soarta pacientului și nu marcajul fiecărui pixel. Caracteristicile au fost extrase de ResNet18, pre-antrenat pe 57 de seturi de date histopatologice. Criteriul final este binar: risc scăzut (benign/ISUP1) vs. risc ridicat (ISUP2-5).
Precizia predicției
Într-un test independent, modelul a atins o ASC de 0,81 pe toate lamelele și o ASC de 0,82 la nivel de pacient. La un prag care a oferit un echilibru acceptabil, sensibilitatea a fost de 0,92, cu o rată de fals pozitive de 0,32 (la nivel de pacient). Cu alte cuvinte, printre persoanele a căror biopsie inițială „a ratat”, inteligența artificială a semnalat corect marea majoritate a celor care au fost confirmați în curând ca având cancer semnificativ clinic, deși cu prețul unor alarme false. Pentru clinică, acesta este un semnal: răspuns „benign” la biopsie ≠ risc zero și poate fi stratificat cantitativ cu ajutorul sticlei digitale.
Ce „observă” exact inteligența artificială în țesutul „normal”?
Interpretarea prin intermediul UMAP și al hărților de atenție a arătat că modificările stromale sunt cele mai informative:
- Mai mult colagen în stromă (compactarea matricei, „fibroză”);
- Mai puține celule musculare netede în jurul glandelor;
- Mai puțin frecvente sunt semnalele subtile din epiteliul glandular, probabil sub rezoluția disponibilă pentru downsampling.
Acest model se încadrează în conceptul TINT (tumour-instructed/indicating normal tissue - țesut normal instruit de tumoră/indicator de țesut normal): chiar și „norma” dintr-un organ în care este ascunsă o tumoare este reconfigurată sub influența acesteia și diferă de „norma” dintr-un organ fără tumoră. Cancerul nu este doar un nidus, ci și un câmp, iar inteligența artificială învață să citească efectul câmpului.
Cum este utilă abordarea în practică - scenarii potențiale
- Re-biopsie bazată pe risc: rată ridicată de IA pe sticlă „curată” - argument în favoarea re-biopsiei timpurii sau a ghidării RMN în loc de așteptare.
- Personalizarea monitorizării: Viteza redusă contrabalansează anxietatea după RMN-ul „la limită” și permite moderarea intensității monitorizării.
- Antrenarea modelului TINT: Hărțile de atenție și suprapunerile interactive îi ajută pe patologi să vadă câmpurile subtile din jurul cancerului, îmbunătățind consecvența rapoartelor.
Este important să înțelegem limitele
Este un centru unic în nordul Suediei (populație predominant caucaziană), designul este retrospectiv, biopsiile inițiale au fost efectuate fără ghidaj RMN (biopsii TRUS sistematice), iar markerii sunt rezultate viitoare, mai degrabă decât „tumoare ocultă pe aceeași lamă”. Nu există încă o validare externă la centre/scanere independente și nici un studiu prospectiv privind efectul algoritmului asupra deciziilor și rezultatelor clinice. Rata fals pozitivă rămâne semnificativă - modelul nu înlocuiește medicul, ci adaugă un nivel probabilistic pentru luarea deciziilor partajate.
Ce urmează: Foaie de parcurs pentru implementare
- Validare externă multicentrică (diferite scanere, protocoale, grupuri etnice).
- Studii decizionale prospective: scorul AI modifică traiectoria pacientului (timpul până la diagnosticare, numărul de biopsii repetate inutile, supra/subdiagnosticare).
- Integrare cu RMN și clinică: modele combinate (PSA, RMN PIRADS, factori clinici + scor TINT conform H&E).
- Etape tehnice: standardizarea digitalizării, controlul derivei datelor, explicabilitate (suprapuneri de atenție pentru rutină).
Sursa: Chelebian E., Avenel C., Järemo H., Andersson P., Bergh A., Wählby C., et al. Descoperirea unei tumori care indică modificări morfologice în biopsiile benigne de prostată prin inteligență artificială. Scientific Reports (Nature Portfolio), publicat pe 21 august 2025. DOI: https://doi.org/10.1038/s41598-025-15105-6
