
Tot conținutul iLive este revizuit din punct de vedere medical sau verificat pentru a vă asigura cât mai multă precizie de fapt.
Avem linii directoare de aprovizionare stricte și legătura numai cu site-uri cu reputație media, instituții de cercetare academică și, ori de câte ori este posibil, studii medicale revizuite de experți. Rețineți că numerele din paranteze ([1], [2], etc.) sunt link-uri clickabile la aceste studii.
Dacă considerați că oricare dintre conținuturile noastre este inexactă, depășită sau îndoielnică, selectați-o și apăsați pe Ctrl + Enter.
Sinteza, secreția și metabolismul catecolaminelor
Expert medical al articolului
Ultima examinare: 06.07.2025
Medulara suprarenală produce compuși cu o structură departe de cea a steroizilor. Aceștia conțin un nucleu 3,4-dihidroxifenil (catecol) și se numesc catecolamine. Printre aceștia se numără adrenalina, noradrenalina și dopamina beta-hidroxitiramina.
Secvența sintezei catecolaminelor este destul de simplă: tirozină → dihidroxifenilalanină (DOPA) → dopamină → norepinefrină → adrenalină. Tirozina intră în organism prin alimente, dar poate fi formată și din fenilalanină în ficat sub acțiunea fenilalaninhidroxilazei. Produșii finali ai conversiei tirozinei în țesuturi sunt diferiți. În medulosuprarenală, procesul continuă până la etapa de formare a adrenalinei, în terminațiile nervilor simpatici - norepinefrină, în unii neuroni ai sistemului nervos central, sinteza catecolaminelor se termină cu formarea dopaminei.
Conversia tirozinei în DOPA este catalizată de tirozin hidroxilază, ai cărei cofactori sunt tetrahidrobiopterina și oxigenul. Se crede că această enzimă limitează rata întregului proces de biosinteză a catecolaminelor și este inhibată de produșii finali ai procesului. Tirozin hidroxilază este principala țintă a efectelor de reglare asupra biosintezei catecolaminelor.
Conversia DOPA în dopamină este catalizată de enzima DOPA decarboxilază (cofactor - fosfat de piridoxal), care este relativ nespecifică și decarboxilează alți L-aminoacizi aromatici. Cu toate acestea, există indicii ale posibilității de modificare a sintezei catecolaminelor prin schimbarea activității acestei enzime. Unor neuroni le lipsesc enzimele pentru conversia ulterioară a dopaminei, aceasta fiind produsul final. Alte țesuturi conțin dopamină beta-hidroxilază (cofactori - cupru, acid ascorbic și oxigen), care transformă dopamina în norepinefrină. În medulara suprarenală (dar nu și în terminațiile nervilor simpatici) este prezentă feniletanolamina - o metiltransferază care formează adrenalină din norepinefrină. În acest caz, S-adenozilmetionina servește ca donator de grupări metil.
Este important de reținut că sinteza feniletanolaminei-N-metiltransferazei este indusă de glucocorticoizii care pătrund în medulară din cortex prin sistemul venos portal. Acest lucru ar putea explica faptul că două glande endocrine diferite sunt combinate într-un singur organ. Importanța glucocorticoizilor pentru sinteza adrenalinei este subliniată de faptul că celulele medularei suprarenale care produc noradrenalină sunt situate în jurul vaselor arteriale, în timp ce celulele producătoare de adrenalină primesc sânge în principal din sinusurile venoase situate în cortexul suprarenal.
Descompunerea catecolaminelor are loc în principal sub influența a două sisteme enzimatice: catecol-O-metiltransferază (COMT) și monoaminooxidază (MAO). Principalele căi de descompunere a adrenalinei și noradrenalinei sunt prezentate schematic în Fig. 54. Sub influența COMT în prezența donorului de grupare metil S-adrenozilmetionină, catecolaminele sunt transformate în normetanefrină și metanefrină (derivați 3-O-metil ai noradrenalinei și adrenalinei), care, sub influența MAO, sunt transformate în aldehide și apoi (în prezența aldehidoxidazei) în acid vanililmandelic (VMA), principalul produs de descompunere al noradrenalinei și adrenalinei. În același caz, atunci când catecolaminele sunt expuse inițial la MAO în loc de COMT, acestea sunt transformate în aldehidă 3,4-dioxomandelică și apoi, sub influența aldehidoxidazei și COMT, în acid 3,4-dioxomandelic și VMC. În prezența alcool dehidrogenazei, din catecolamine se poate forma 3-metoxi-4-oxifenilglicolul, care este principalul produs final al degradării adrenalinei și noradrenalinei în SNC.
Descompunerea dopaminei este similară, cu excepția faptului că metaboliților săi le lipsește gruparea hidroxil la atomul de carbon beta și, prin urmare, în loc de acid vanililmandelic, se formează acid homovanilic (HVA) sau acid 3-metoxi-4-hidroxifenilacetic.
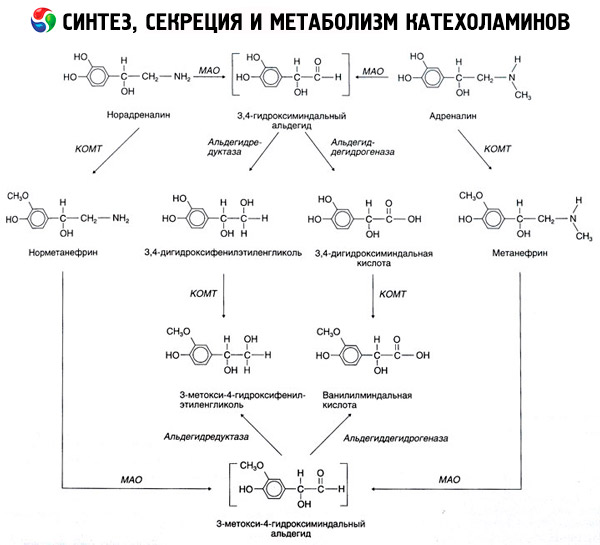
Se postulează, de asemenea, existența unei căi chinoide de oxidare a moleculei de catecolamină, care poate produce produse intermediare cu activitate biologică pronunțată.
Norepinefrina și adrenalina formate sub acțiunea enzimelor citosolice din terminațiile nervoase simpatice și din medulosuprarenală pătrund în granulele secretorii, ceea ce le protejează de acțiunea enzimelor de degradare. Captarea catecolaminelor de către granule necesită cheltuieli energetice. În granulele cromafine ale medulosuprarenalei, catecolaminele sunt strâns legate de ATP (într-un raport de 4:1) și de proteine specifice - cromogranine, ceea ce împiedică difuzia hormonilor din granule în citoplasmă.
Stimulul direct pentru secreția de catecolamine este, aparent, pătrunderea calciului în celulă, stimulând exocitoza (fuziunea membranei granulare cu suprafața celulară și ruptura acestora cu eliberarea completă a conținutului solubil - catecolamine, dopamină beta-hidroxilază, ATP și cromogranine - în fluidul extracelular).
Efectele fiziologice ale catecolaminelor și mecanismul lor de acțiune
Efectele catecolaminelor încep prin interacțiunea cu receptori specifici ai celulelor țintă. În timp ce receptorii pentru hormonii tiroidieni și steroizi sunt localizați în interiorul celulelor, receptorii pentru catecolamine (precum și acetilcolină și hormonii peptidici) sunt prezenți pe suprafața externă a celulei.
De mult timp s-a stabilit că, în raport cu unele reacții, adrenalina sau noradrenalina sunt mai eficiente decât catecolamina sintetică izoproterenol, în timp ce, în raport cu altele, efectul izoproterenolului este superior acțiunilor adrenalinei sau noradrenalinei. Pe această bază, s-a dezvoltat un concept despre prezența a două tipuri de receptori adrenergici în țesuturi: alfa și beta, iar în unele dintre ele poate fi prezent doar unul dintre aceste două tipuri. Izoproterenolul este cel mai puternic agonist al beta-adrenergicilor, în timp ce compusul sintetic fenilefrina este cel mai puternic agonist al alfa-adrenergicilor. Catecolaminele naturale - adrenalina și noradrenalina - sunt capabile să interacționeze cu receptorii ambelor tipuri, dar adrenalina prezintă o afinitate mai mare pentru beta-, iar noradrenalina - pentru alfa-receptori.
Catecolaminele activează receptorii beta-adrenergici cardiaci mai puternic decât beta-receptorii musculari netezi, ceea ce a permis împărțirea tipului beta în subtipuri: beta-receptori (inimă, celule adipoase) și beta-receptori (bronhii, vase de sânge etc.). Efectul izoproterenolului asupra receptorilor beta-1 depășește efectul adrenalinei și noradrenalinei de doar 10 ori, în timp ce asupra receptorilor beta-2 acționează de 100-1000 de ori mai puternic decât catecolaminele naturale.
Utilizarea unor antagoniști specifici (fentolamină și fenoxibenzamină pentru alfa- și propranolol pentru beta-receptori) a confirmat caracterul adecvat al clasificării adrenergicepților. Dopamina este capabilă să interacționeze atât cu alfa-, cât și cu beta-receptori, dar diverse țesuturi (creier, glanda pituitară, vase) au și proprii receptori dopaminergici, al căror blocant specific este haloperidolul. Numărul de beta-receptori variază de la 1000 la 2000 per celulă. Efectele biologice ale catecolaminelor mediate de beta-receptori sunt de obicei asociate cu activarea adenilat ciclazei și o creștere a conținutului intracelular de cAMP. Deși receptorul și enzima sunt conectați funcțional, sunt macromolecule diferite. Guanozin trifosfatul (GTP) și alte nucleotide purinice participă la modularea activității adenilat ciclazei sub influența complexului hormon-receptor. Prin creșterea activității enzimatice, se pare că acestea reduc afinitatea receptorilor beta pentru agoniști.
Fenomenul creșterii sensibilității structurilor denervate este cunoscut de mult timp. Dimpotrivă, expunerea prelungită la agoniști reduce sensibilitatea țesuturilor țintă. Studiul receptorilor beta a permis explicarea acestor fenomene. S-a demonstrat că expunerea prelungită la izoproterenol duce la o pierdere a sensibilității adenilat ciclazei din cauza scăderii numărului de receptori beta.
Procesul de desensibilizare nu necesită activarea sintezei proteinelor și se datorează probabil formării treptate a complexelor hormon-receptor ireversibile. Dimpotrivă, introducerea 6-oxidopaminei, care distruge terminațiile simpatice, este însoțită de o creștere a numărului de beta-receptori reactivi în țesuturi. Este posibil ca o creștere a activității nervoase simpatice să provoace și desensibilizarea legată de vârstă a vaselor de sânge și a țesutului adipos în raport cu catecolaminele.
Numărul de receptori adrenergici din diferite organe poate fi controlat de alți hormoni. Astfel, estradiolul crește, iar progesteronul scade numărul de receptori alfa-adrenergici din uter, ceea ce este însoțit de o creștere și o scădere corespunzătoare a răspunsului său contractil la catecolamine. Dacă „mesagerul secundar” intracelular format prin acțiunea agoniștilor beta-receptori este cu siguranță cAMP, atunci situația în ceea ce privește transmițătorul efectelor alfa-adrenergice este mai complicată. Se presupune existența diverselor mecanisme: o scădere a nivelului de cAMP, o creștere a conținutului de cAMP, modularea dinamicii calciului celular etc.
Pentru a reproduce diverse efecte în organism, sunt necesare de obicei doze de adrenalină de 5-10 ori mai mici decât noradrenalina. Deși aceasta din urmă este mai eficientă în raport cu receptorii α și beta1-adrenergici, este important să ne amintim că ambele catecolamine endogene sunt capabile să interacționeze atât cu receptorii alfa, cât și cu cei beta. Prin urmare, răspunsul biologic al unui anumit organ la activarea adrenergică depinde în mare măsură de tipul de receptori prezenți în acesta. Totuși, aceasta nu înseamnă că activarea selectivă a legăturii nervoase sau umorale a sistemului simpatico-adrenal este imposibilă. În majoritatea cazurilor, se observă o activitate crescută a diferitelor sale legături. Astfel, este în general acceptat faptul că hipoglicemia activează reflexiv medulosuprarenala, în timp ce o scădere a tensiunii arteriale (hipotensiune posturală) este însoțită în principal de eliberarea de noradrenalină din terminațiile nervilor simpatici.
Adrenoreceptorii și efectele activării lor în diverse țesuturi
Sistem, organ |
Tipul receptorului adrenergic |
Reacţie |
Sistemul cardiovascular: |
||
Inimă |
Beta |
Creșterea ritmului cardiac, a conductivității și a contractilității |
Arteriole: |
||
Piele și mucoase |
Alfa |
Reducere |
Mușchii scheletici |
Beta |
Expansiune Contracție |
Organele abdominale |
Alfa (mai mult) |
Reducere |
Beta |
Extensie |
|
Vene |
Alfa |
Reducere |
Sistemul respirator: |
||
Mușchii bronhiilor |
Beta |
Extensie |
Sistem digestiv: |
||
Stomac |
Beta |
Scăderea abilităților motorii |
Intestinele |
Alfa |
Contracția sfincterelor |
Splină |
Alfa |
Reducere |
Beta |
Relaxare |
|
Pancreasul exocrin |
Alfa |
Scăderea secreției |
Sistemul urogenital: |
Alfa |
Contracția sfincterului |
Vezică urinară |
Beta |
Relaxarea mușchiului ejector |
Organele genitale masculine |
Alfa |
Ejaculare |
Ochi |
Alfa |
Dilatarea pupilelor |
Piele |
Alfa |
Transpirație crescută |
Glandele salivare |
Alfa |
Excreția de potasiu și apă |
Beta |
Secreția de amilază |
|
Glandele endocrine: |
||
Insulele pancreasului |
||
Celulele beta |
Alfa (mai mult) |
Scăderea secreției de insulină |
Beta |
Creșterea secreției de insulină |
|
Celulele alfa |
Beta |
Creșterea secreției de glucagon |
8 celule |
Beta |
Creșterea secreției de somatostatină |
Hipotalamus și glanda pituitară: |
||
Somatotrofe |
Alfa |
Creșterea secreției de STH |
Beta |
Scăderea secreției de STH |
|
Lactotrofe |
Alfa |
Scăderea secreției de prolactină |
Tirotrofe |
Alfa |
Scăderea secreției de TSH |
Corticotrofe |
Alfa |
Creșterea secreției de ACTH |
| beta | Scăderea secreției de ACTH | |
Glanda tiroidă: |
||
Celule foliculare |
Alfa |
Scăderea secreției de tiroxină |
Beta |
Creșterea secreției de tiroxină |
|
Celule parafoliculare (K) |
Beta |
Creșterea secreției de calcitonină |
Glandele paratiroide |
Beta |
Creșterea secreției de PTH |
Rinichi |
Beta |
Creșterea secreției de renină |
Stomac |
Beta |
Creșterea secreției de gastrină |
BX |
Beta |
Consum crescut de oxigen |
Ficat |
? |
Glicogenoliză și gluconeogeneză crescute odată cu eliberarea de glucoză; cetogeneză crescută odată cu eliberarea de corpi cetonici |
Țesut adipos |
Beta |
Creșterea lipolizei cu eliberarea de acizi grași liberi și glicerol |
Mușchii scheletici |
Beta |
Glicoliză crescută cu eliberarea de piruvat și lactat; proteoliză scăzută cu o scădere a eliberării de alanină și glutamină |
Este important de luat în considerare faptul că rezultatele administrării intravenoase de catecolamine nu reflectă întotdeauna în mod adecvat efectele compușilor endogeni. Acest lucru se aplică în principal norepinefrinei, deoarece în organism aceasta este eliberată în principal nu în sânge, ci direct în fantele sinaptice. Prin urmare, norepinefrina endogenă activează, de exemplu, nu numai receptorii alfa vasculari (creșterea tensiunii arteriale), ci și receptorii beta ai inimii (creșterea ritmului cardiac), în timp ce introducerea norepinefrinei din exterior duce în principal la activarea receptorilor alfa vasculari și la o încetinire reflexă (prin intermediul vagului) a bătăilor inimii.
Dozele mici de adrenalină activează în principal receptorii beta ai vaselor musculare și ai inimii, rezultând o scădere a rezistenței vasculare periferice și o creștere a debitului cardiac. În unele cazuri, primul efect poate prevala, iar după administrarea de adrenalină se dezvoltă hipotensiune arterială. În doze mai mari, adrenalina activează și receptorii alfa, ceea ce este însoțit de o creștere a rezistenței vasculare periferice și, pe fondul unei creșteri a debitului cardiac, duce la o creștere a presiunii arteriale. Cu toate acestea, efectul său asupra receptorilor beta vasculari este, de asemenea, menținut. Ca urmare, creșterea presiunii sistolice depășește indicatorul similar al presiunii diastolice (creșterea presiunii pulsului). Odată cu introducerea unor doze și mai mari, efectele alfa-mimetice ale adrenalinei încep să predomine: presiunea sistolică și diastolică cresc în paralel, ca și sub influența norepinefrinei.
Efectul catecolaminelor asupra metabolismului constă în efectele lor directe și indirecte. Primele se realizează în principal prin intermediul receptorilor beta. Procese mai complexe sunt asociate cu ficatul. Deși creșterea glicogenolizei hepatice este considerată în mod tradițional a fi rezultatul activării receptorilor beta, există și dovezi ale implicării receptorilor alfa. Efectele indirecte ale catecolaminelor sunt asociate cu modularea secreției multor alți hormoni, cum ar fi insulina. În efectul adrenalinei asupra secreției acesteia, predomină în mod clar componenta alfa-adrenergică, deoarece s-a demonstrat că orice stres este însoțit de inhibarea secreției de insulină.
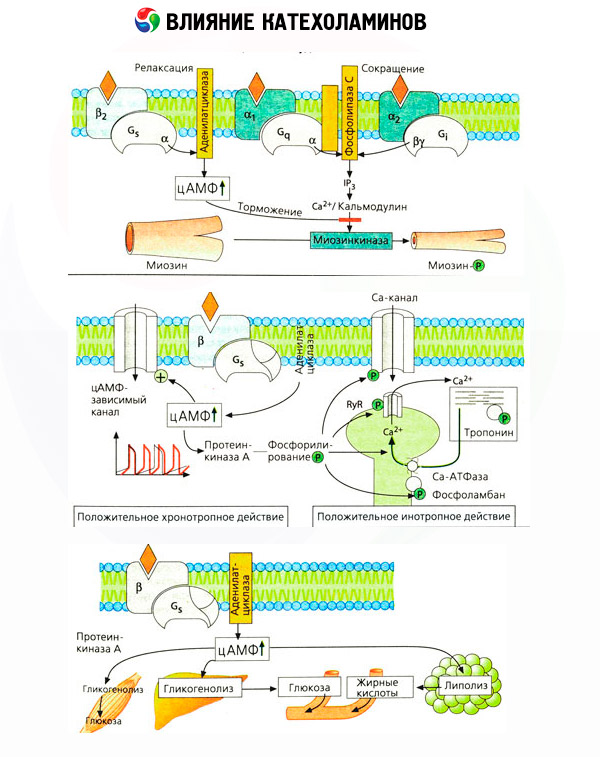
Combinația efectelor directe și indirecte ale catecolaminelor provoacă hiperglicemie, asociată nu numai cu creșterea producției hepatice de glucoză, ci și cu inhibarea utilizării acesteia de către țesuturile periferice. Accelerarea lipolizei provoacă hiperlipacidemie cu creșterea aportului de acizi grași către ficat și intensificarea producției de corpi cetonici. Glicoliza crescută în mușchi duce la o creștere a eliberării de lactat și piruvat în sânge, care, împreună cu glicerolul eliberat din țesutul adipos, servesc ca precursori ai gluconeogenezei hepatice.
Reglarea secreției de catecolamine. Similitudinea produselor și metodelor de reacție ale sistemului nervos simpatic și ale medulei adrenale a stat la baza combinării acestor structuri într-un singur sistem simpatico-adrenal al organismului, cu alocarea legăturilor sale nervoase și hormonale. Diverse semnale aferente sunt concentrate în hipotalamus și în centrii măduvei spinării și ai medulei oblongate, de unde provin mesajele eferente, trecând la corpurile celulare ale neuronilor preganglionari situați în coarnele laterale ale măduvei spinării la nivelul segmentelor VIII cervical - II-III lombare.
Axonii preganglionici ai acestor celule părăsesc măduva spinării și formează conexiuni sinaptice cu neuronii situați în ganglionii lanțului simpatic sau cu celulele medulosuprarenale. Aceste fibre preganglionice sunt colinergice. Prima diferență fundamentală între neuronii postganglionici simpatici și celulele cromafine ale medulosuprarenalei este că aceștia din urmă transmit semnalul colinergic primit de ei nu prin conducere nervoasă (nervi adrenergici postganglionari), ci pe cale umorală, eliberând compuși adrenergici în sânge. A doua diferență este că nervii postganglionari produc norepinefrină, în timp ce celulele medulosuprarenale produc în principal adrenalină. Aceste două substanțe au efecte diferite asupra țesuturilor.

